GelMA 3D打印水凝胶异步药物输送系统用于脑胶质瘤术后防复发和神经再生
时间:2024-06-27 11:50 来源:3D打印水凝胶 作者:admin 阅读:次

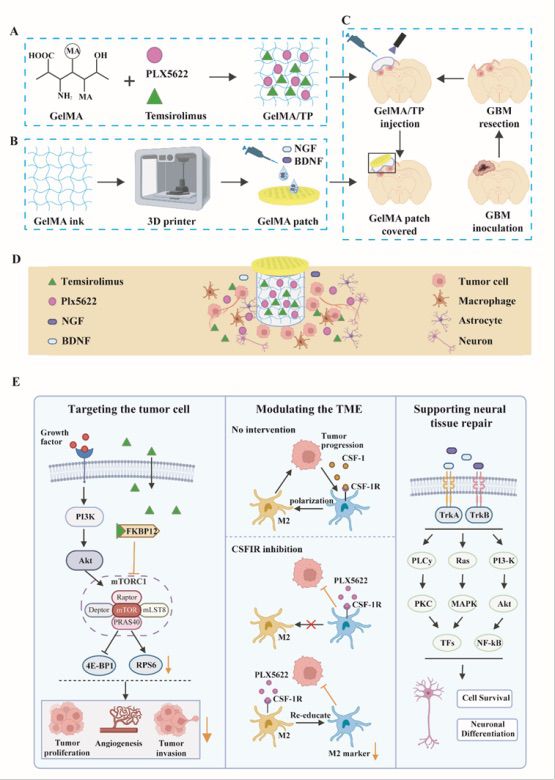
图1 组装嵌入式 3D 水凝胶系统(GelMA/TPNB)用于异步药物输送以抑制恶性胶质瘤术后复发并促进神经恢复
本研究在小鼠上建立复发GBM模型,以模拟人胶质瘤复发过程。通过对人源的肿瘤细胞的转录组数据的DEGs进行GO和KEGG富集分析,发现与原发胶质瘤比较,复发胶质瘤中与EMT相关的基因表达升高。接下来,该研究团队深入分析了促进胶质瘤的侵袭、迁移能力以及血管生成能力的分子基础并发性发现复发性 GBM 肿瘤细胞中mTOR信号通路基因表达上调。接着,该研究团队通过细胞实验结果证实了mTOR抑制剂替西罗莫司(Temsirolimus)能有效的抑制胶质母细胞瘤细胞的增殖。此外,恶性胶质瘤的另一重要标志是难以抑制的肿瘤免疫微环境(TME)。通过对鼠源的肿瘤微环境细胞的转录组数据分析和人源的原发胶质瘤与复发胶质瘤的单细胞转录组数据分析,该研究团队发现与原发胶质瘤相比,复发胶质瘤的肿瘤相关巨噬细胞 (TAMs) 的表型由原来的促炎型(M1)转变为抗炎型(M2)。接着,转录组数据和数据库单细胞转录组数据分析结果显示CSF-1/CSF-1R在复发胶质瘤中高表达。因此,该研究团队选择PLX5622,一种选择性CSF-1R抑制剂,以重塑肿瘤微环境抑制肿瘤的免疫逃逸和生长。动物实验结果表明PLX5622能有效清除小鼠大脑中的小胶质细胞。综合转录组数据和单细胞测序数据的分析结果,该研究团队找到了治疗复发胶质瘤潜在的双重靶点,即mTOR复合物及CSF-1/CSF-1R信号,可以同时靶向肿瘤细胞和免疫微环境细胞。双重靶点能够有效的解决单靶向药物无法充分阻断肿瘤细胞的生长、扩散和易产生耐药性的问题。

图2 原发性GBM与复发性GBM肿瘤细胞中差异表达基因的生物信息学分析
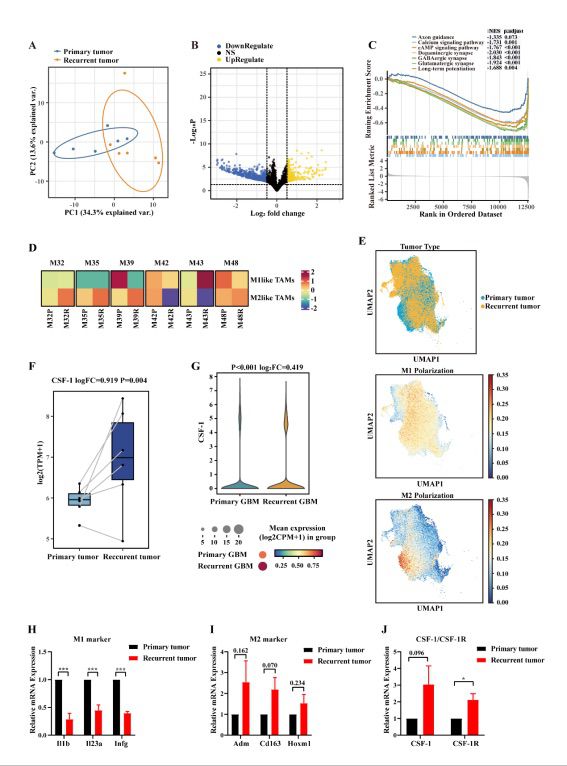
图3 原发性GBM与复发性GBM TME中差异表达基因的生物信息学分析
鉴于常规的抑制剂给药方式带来严重的副作用和脑部血脑屏障对药物递送的阻碍,该研究团队开发了一种具有生物相容性的甲基丙烯酸酯改性明胶 (GelMA) 可注射水凝胶以完美贴合胶质瘤切除术后的不规则腔体。为了避免异物反应,该研究团队选择使用低溶胀性的 10% 质量分数的 GelMA 作为脑部药物递送载体,并且具有与天然脑组织相似的机械强度和生物降解性。该研究团队结合开发的新型双靶向疗法制备了载有PLX5622和Temsirolimus的10% GelMA水凝胶(GelMA/TP),以对肿瘤细胞及其生长的微环境产生协同抑制作用。
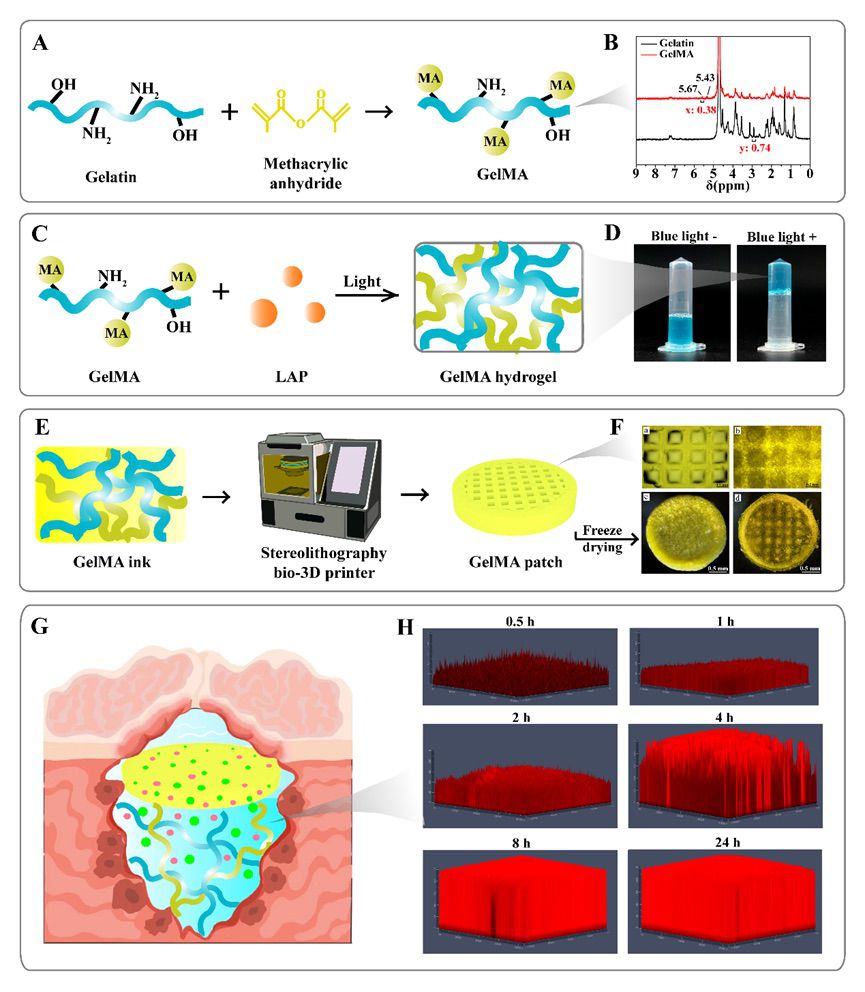
图4 3D异步药物递送系统的构建和表征
我们利用裸鼠建立了GBM术后切除模型以评估GelMA/TP水凝胶抑制GBM复发的功效。实验结果表明GelMA/TP显著提高了裸鼠的总体生存率,超过 50% 的小鼠在切除后 120 天内仍然存活。H&E染色结果显示GelMA/TP治疗后切除腔内的肿瘤细胞明显减少。免疫荧光染色结果显示GelMA/TP 治疗的小鼠的脑组织中观察到大量 BrdU 阳性细胞和少量的Ki67阳性细胞,表明了GelMA/TP有效抑制了切除后残留肿瘤细胞的增殖。此外,GelMA/TP 组的磷酸化 S6 核糖体蛋白 (RPS6)明显减少,mTOR 通路基因的表达水平显着下降且血管生成减少。此外,GelMA/TP 组中 IBA1 阳性细胞的存在明显减少且M2 表型相关的标志物下调。这些结果表明 GelMA/TP 治疗调节了TME以阻止肿瘤进展并减轻神经胶质瘤复发。同时,GelMA/TP水凝胶在植入脑内121天后完全降解且外周器官的H&E染色结果并未呈现异常病变,表明了该水凝胶系统的生物降解性和生物相容性。
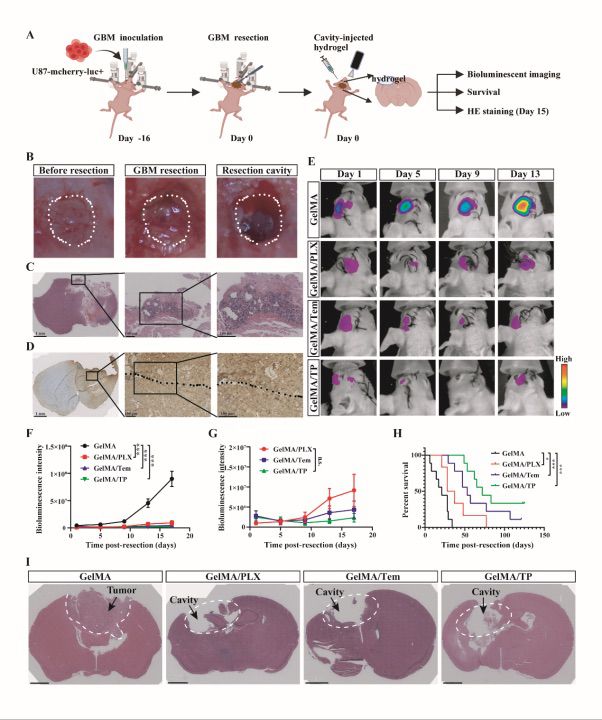
图5 GelMA/TP显著抑制了肿瘤复发并延长了切除后 GBM 小鼠的生存期
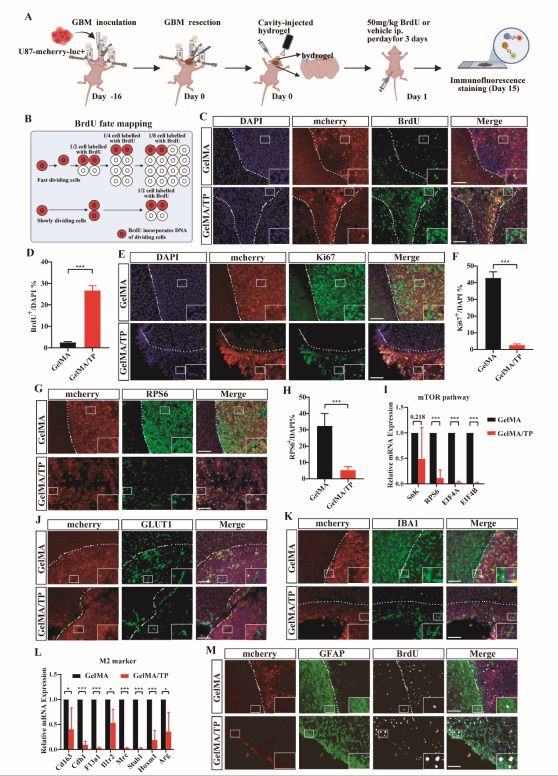
图6 GelMA/TP对于 mTOR 通路和 TME 的调节在GBM治疗中
为了解决 GBM 手术后的神经系统后遗症,该研究团队构建了一个载有BDNF 和 NGF 的 3D 打印 GelMA 补片。受海绵结构的启发,该研究团队通过立体光刻 3D 打印技术制备了具有大孔结构的 GelMA 水凝胶补片,并将神经生长因子 (NGF) 和脑源性神经营养因子 (BDNF) 滴在冻干贴片上以制备因子浸润的海绵载体。接着,载有因子的海绵被放置在 GelMA 植入材料上,使神经营养因子缓慢向下扩散。动物实验结果表明,这种新型 3D 药物输送系统可有效促进轴突发芽潜力,同时并不阻碍 GBM 的治疗功效。
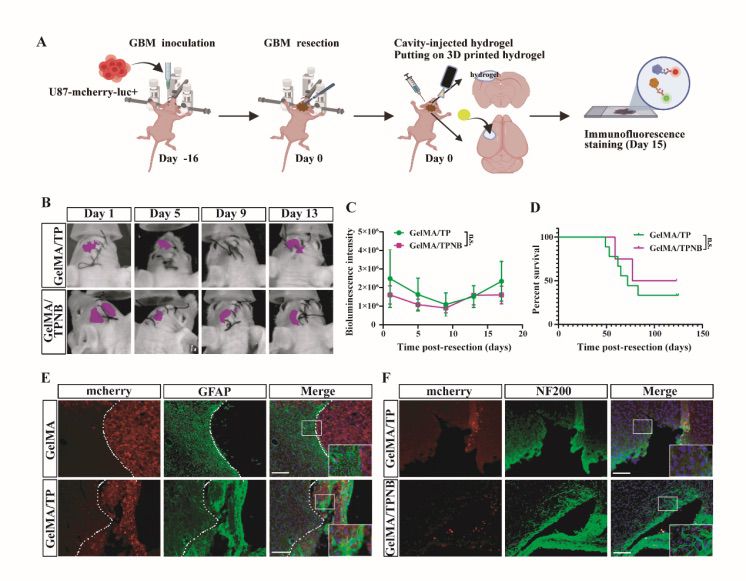
图7 GelMA/TPNB治疗后小鼠脑组织中的轴突发芽和抑制GBM的功效
文章来源:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202401383
(责任编辑:admin)
最新内容
热点内容


 CNES引入INTAMSYS聚合物FF
CNES引入INTAMSYS聚合物FF 具有显著纵波传播特性的三
具有显著纵波传播特性的三 生物3D打印、类器官应用,
生物3D打印、类器官应用, MIT新突破:无需半导体也
MIT新突破:无需半导体也 亚马逊和Holcim投资14Tree
亚马逊和Holcim投资14Tree 回收SLS 3D打印尼龙废料,
回收SLS 3D打印尼龙废料, 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强 《Science》:一
《Science》:一 国产大尺寸陶瓷3D
国产大尺寸陶瓷3D 南京工业大学:基
南京工业大学:基

