投影式光固化3D打印高仿生支架负载工程化纳米囊泡促进大段骨再生
时间:2024-04-24 09:25 来源:EFL生物3D打印与生物制造 作者:admin 阅读:次
来自华中科技大学的孙家明团队在骨的天然微通道和皮质网络的启发下,利用投影式光固化3D打印技术(EFL-BP8601 Pro)制作了高仿生结构的PCLMA骨支架,该支架具有外层骨皮质、内层复杂网状的松质骨、Haversian管和横向穿透的Volkmann管。随后通过生物素-链霉亲和素系统将脂肪干细胞来源工程化纳米囊泡(ADSC-ENs)稳定地负载到支架表面。该支架为骨缺损区提供了具有合适活性成分的仿生结构支撑,人工构建了缺损区的局部血管化和成骨微环境。实验结果表明,该支架具有良好的生物相容性,能显著促进血管生成和成骨过程。相关工作以题为“Synergistic large segmental bone repair by 3D printed bionic scaffolds and engineered ADSC nanovesicles: Towards an optimized regenerative microenvironment”的文章发表在2024年4月8日的国际知名期刊《Biomaterials》。

1. 创新型研究内容
【工程化纳米囊泡的表征与生物素化】
为了获得高产量的工程化纳米囊泡(ENs),作者团队采用机械挤压的方法,分别使用10μm、5μm和1μm孔径的膜连续挤压ADSCs。扫描电子显微镜(SEM)显示ENs的形态为椭圆形(图1A)。纳米颗粒跟踪分析(NTA)进一步证明,ENs的尺寸在50-150 nm之间,最大峰位于62±1.5 nm,颗粒数量占总颗粒的86.35%(n=3)(图1B)。蛋白质定量显示,1×107ADSC获得的ENs蛋白质浓度可达88.35±6.62μg/mL,而同等数量ADSC获得的细胞外囊泡(EVs)的蛋白质浓度仅为2.85±1.04μg/mL(n=3)(图1C)。对EVs、ENs和细胞的考马斯亮蓝分析表明,ENs和细胞的蛋白质浓度具有非常相似的SDS-PAGE图谱,而EVs的SDS-PAGE图谱则完全不同(图1E)。其次,将生物素功能化的1,2-dioleoyl-sn-glycero-3-phosphoethanolaminepoly(乙二醇基)(DSPE-聚乙二醇)(DSPE-聚乙二醇-生物素)用于机械挤出改性ENs。用FITC标记的链霉亲和素对ENs的修饰结果进行了评估,荧光显微镜图像显示生物素成功地修饰到ENs上(图1D)。
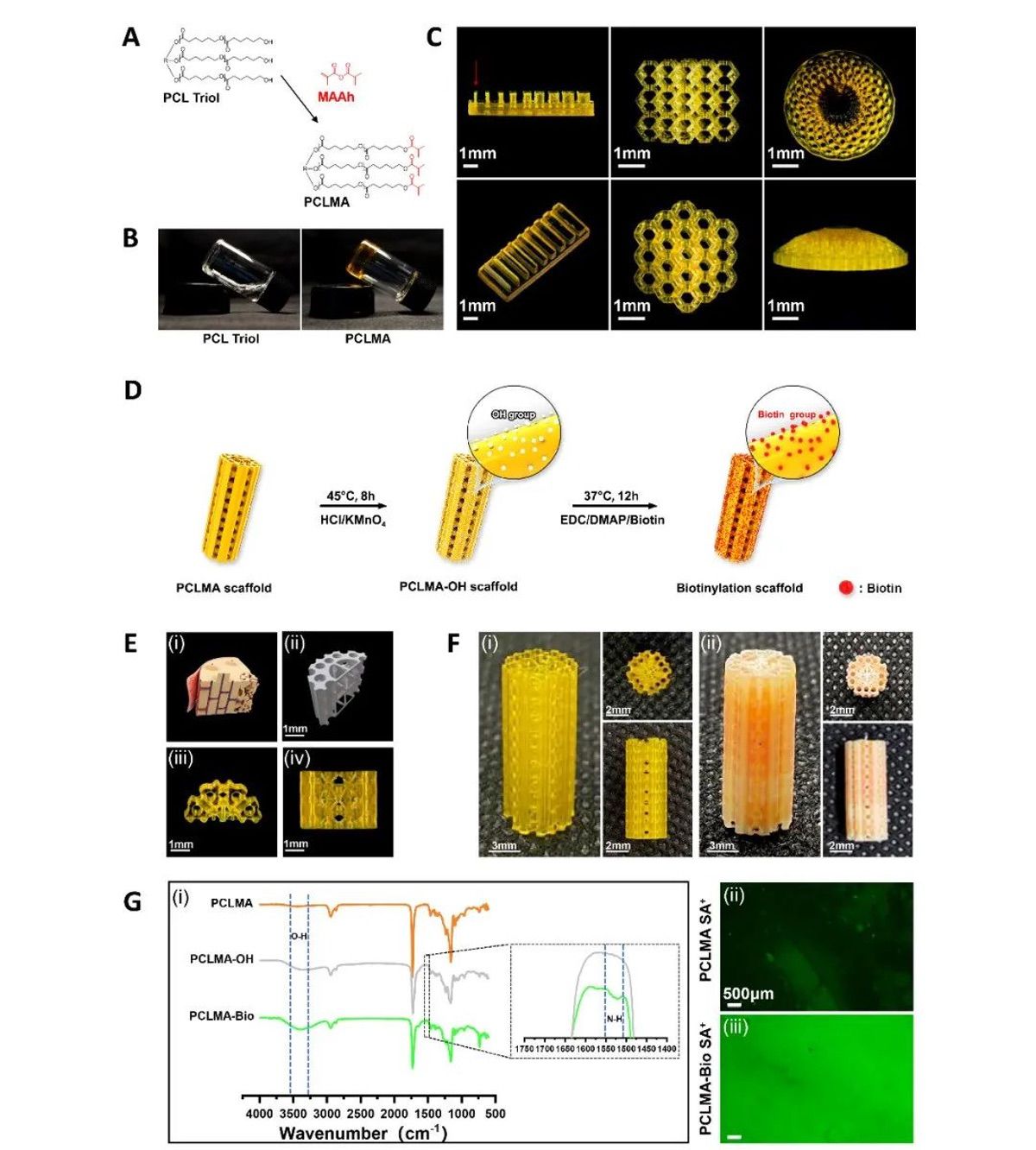
图1 工程化纳米囊泡的生表征与生物素化
【PCLMA的表征及材料的表面生物素化】
首先,使用MAAh对三臂聚己内酯(PCL)进行改性为PCLMA,以满足PCL材料的光固化性能(图2A)。用PCLMA树脂进行光交联后的光学图像表明,MAAh改性的三臂PCL具有光固化能力,在405 nm紫外光照射20 S后达到稳定固化(图2B)。随后,利用投影式光固化3D打印技术对PCLMA的打印性能进行了研究,并设计了不同的结构进行打印精度测试。此外,还使用了微距镜头进行多角度摄影,以探索印刷细节。结果表明,PCLMA可以以高打印精度打印各种三维结构,红色箭头表示PCLMA可以打印高达100μm(图2C)。由于在合成PCLMA的过程中,过量的MAAH取代了几乎所有的末端羟基,仿生支架的表面首先用盐酸和高锰酸钾处理,暴露了表面的羟基,然后进一步对生物素进行修饰,以实现支架表面的生物素修饰。接下来,生物素在仿生支架的表面被修饰,以允许更好地负载ENS(图2D)。仿生骨支架设计有中央髓管、外周哈弗管和外侧Volkmann管,以探索其使用PCLMA材料打印的可行性(图2E)。随后,用生物素对仿生骨支架进行生物素修饰,以用于链霉亲和素的接枝。最后,在各个角度下观察了支架的细节,PCLMA支架和生物化支架都具有良好的仿生结构(图2F)。FT-IR分析表明,与PCLMA相比,经HCl/KMnO4处理后得到的PCLMA-OH在3300-3650 cm-1处有一个峰,表明表面羟基暴露。此外,生物素化的PCLMA(PCLMA-Bio)在1500-1580 cm-1处有一个微小的峰,与PCLMA-OH相比略有移动,从而证实了生物素通过EDC/DMAP化学偶联成功地接枝到支架表面。接下来,用FITC标记链霉亲和素,荧光显微镜显示PCLMA-Bio Avidin+与PCLMA相比具有更强的荧光信号,这同样表明PCLMA成功的生物素化(图2G)。
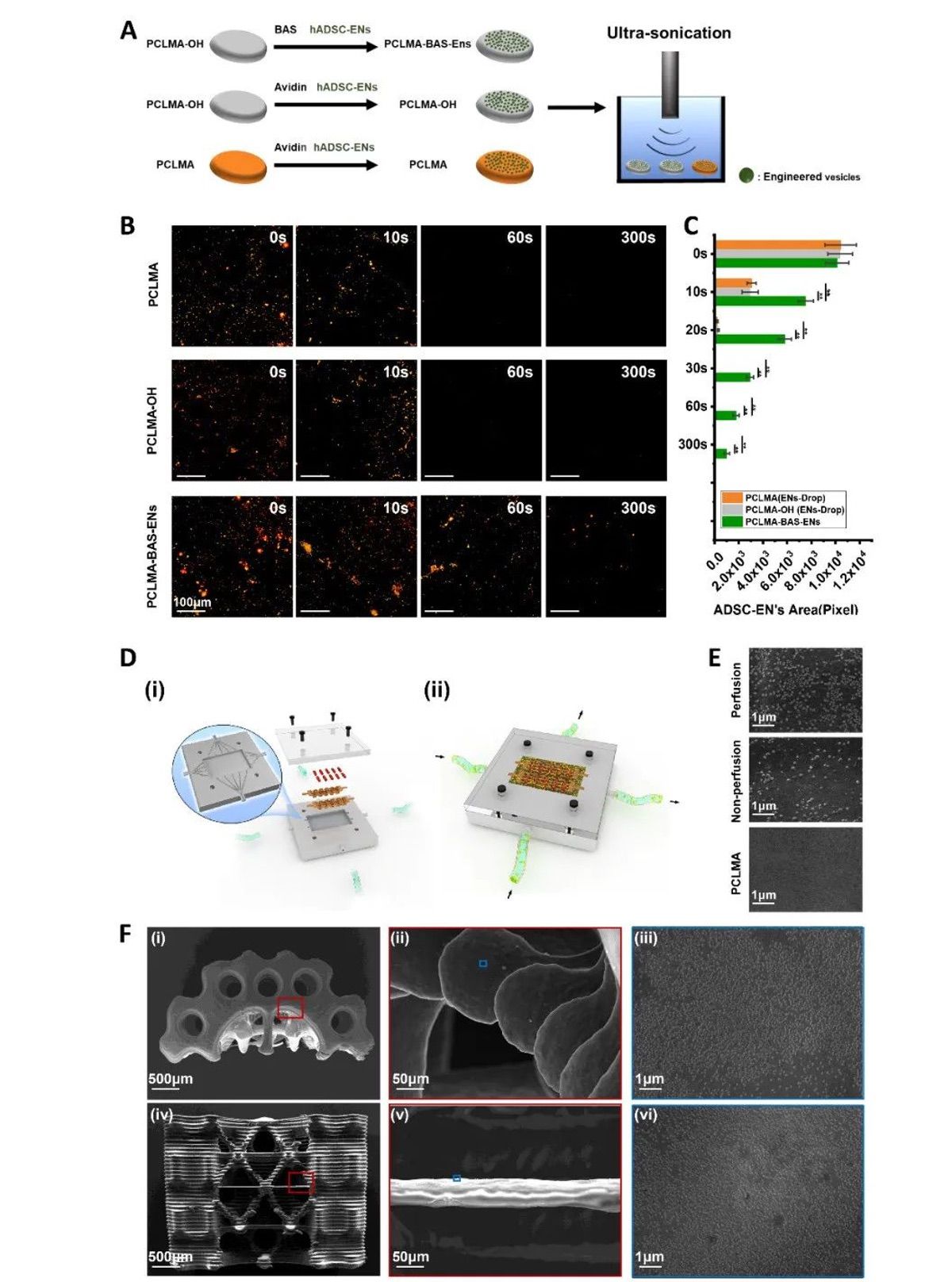
图2 PCLMA的表征及材料的表面生物素化
【ENs在材料表面的稳定接枝】
为了验证支架在体外的接枝稳定性,在链霉亲和素存在的情况下,将生物素化的 ADSC-ENs 与生物素化的 PCLMA、PCLMA-OH 和纯 PCLMA 共同培养,然后用超声波清洗器进行超声处理,以测试其机械稳定性(图 3A)。荧光图像显示,随着超声处理时间的延长,ADSC-ENs 的保留率逐渐下降。超声处理 60 秒后,可在生物素化 PCLMA 上清晰地检测到红色荧光标记的 ADSC-EN;相比之下,PCLMA-OH 或 PCLMA 上几乎没有荧光区域(图 3B)。更具体地说,60 秒时 PCLMA-BAS-ENs、PCLMA-OH 和 PCLMA 的荧光面积(像素)分别为 1784.80 ± 259.24、10.00 ± 3.74 和 9.80 ± 3.81(图 3C)。为了改善复杂结构支架中的囊泡负载,作者设计了一种具有不同灌注方向的灌注系统,用于在仿生支架上进行ENs的接枝,该系统由一个灌注室、两个数字控制蠕动泵和两个介质容器组成。设计的灌注室由两部分组成:灌注部分和顶部(图 3D)。前者由白色感光树脂制成,用于容纳灌注支架,后者由半透明树脂制成,用于实时观察。灌注部分的中央最多可放置两根支撑杆,用于固定多个仿生支架。此外,腔体内还有四个固定钉,用于在打印前分别固定顶部和灌注部分。值得注意的是,灌注部分包含用于与介质灌注系统建立连接的孔口,宏观上分为相互垂直的两个方向,所有孔口的直径均为 2 毫米。为了确定复杂结构支架中负载的 ENs 的稳定性,使用了超声波清洗器。扫描电子显微镜图像证实,超声处理 30 秒后,灌注接枝组表面的ENs数量明显高于未灌注接枝组,而未接枝组表面几乎没有ENs残留(图 3E),作者推断灌注装置显著提高了ENs在支架表面的接枝效率。灌注接枝组支架不同部位的扫描电子显微镜图像显示,ENs 在支架表面的所有部位都实现了均匀高效的负载,甚至在支架骨髓腔内复杂结构的表面也是如此(图 3F)。
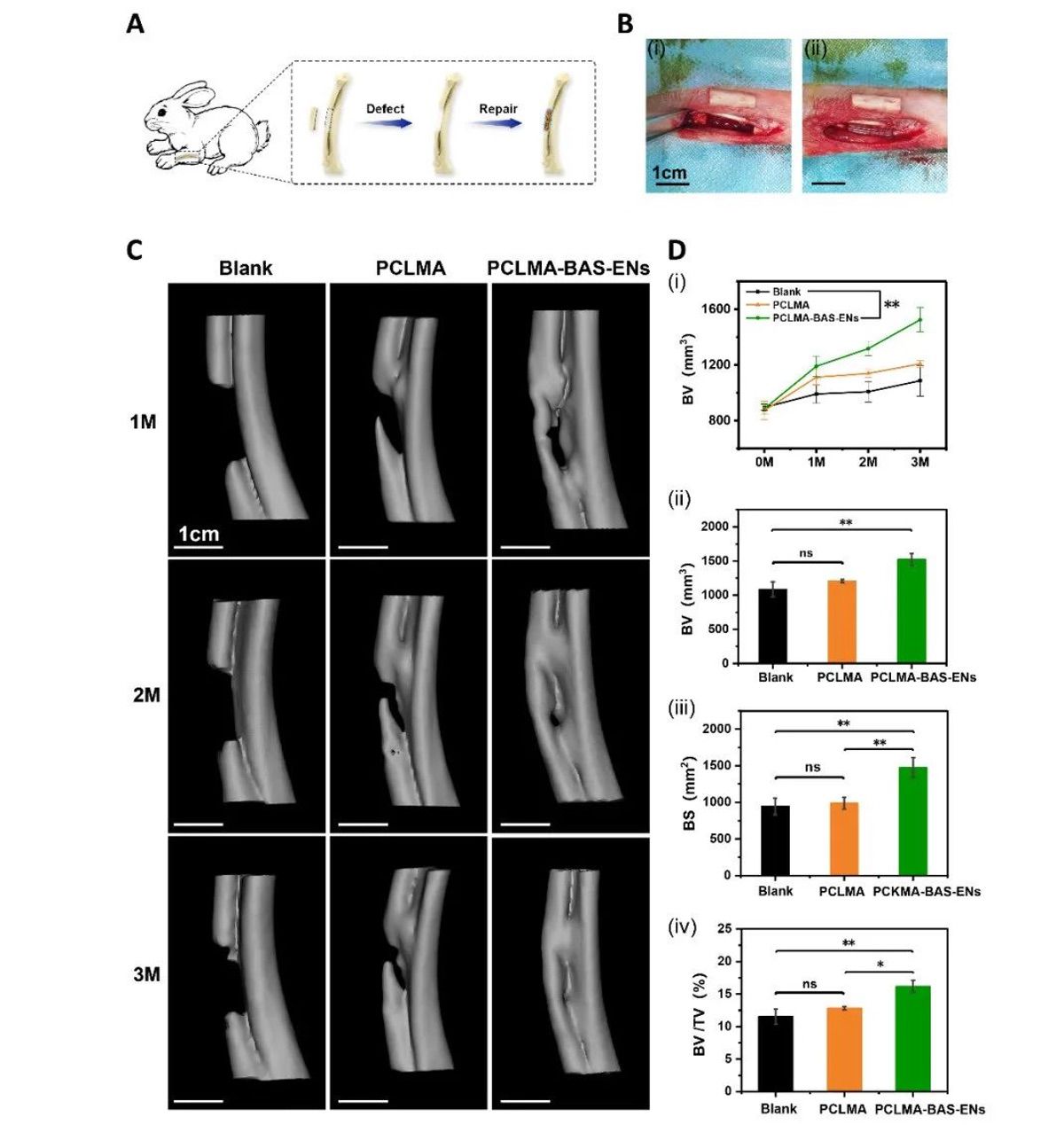
图3 ENs在材料表面的稳定接枝
【PCLMA-BAS-ENs支架修复兔骨缺损的实验研究】
为了进一步验证该策略在临床应用中的潜力,作者采用了兔桡骨原位骨形成试验来分析两种支架的成骨能力(图 4A-B),并用生物素-链霉亲和素法负载 ENs 的 PCLMA 支架(PCLMA-BAS-ENs 组)和纯 PCLMA 支架(PCLMA 组)修复兔桡骨的大段骨缺损(15 mm 长)。第 1、2 和 3 个月的活体 CT 成像显示,三组兔子的骨缺损修复状况存在显著差异,PCLMA-BAS-ENs 组的大部分骨缺损在第 3 个月时已经修复,缺损区域两侧的骨结合更完整、更连续,运动和活动功能恢复正常。第 1、2 和 3 个月的活体 CT 成像显示,三组兔子的骨缺损修复状况存在显著差异。到第三个月时,PCLMA-BAS-ENs 组的大部分骨缺损已经修复,缺损区两侧的骨结合相对完整,运动和活动功能恢复正常。PCLMA 组仅有一小部分骨组织得到修复,但仍明显缺乏骨再生。正如预期的那样,未经处理的空白组几乎没有修复的迹象(图 4C)。值得注意的是,定量分析确定PCLMA-BAS-ENs组的大多数定量指标均高于 PCLMA 组和空白对照组,这表明负载 ENs 的仿生支架所创造的诱导骨微环境在骨再生中发挥了重要作用(图 4D)。与上述检查结果一致,12 周时的组织学染色显示,PCLMA-BAS-ENs组整个骨缺损区域的骨形成相对完整,有大片可见的未成熟胶原纤维(蓝色区域)。在 PCLMA 组中,缺损区中央区域可见明显的骨再生和纤维组织形成,以及不连续的骨结合。在未经处理的空白组中,缺损区中央区域有明显的组织缺失区域(图 5A-B)。尤其是术后 12 周时,PCLMA-BAS-ENs 内的内皮细胞发育良好且连续。更重要的是,这些结果证实了载入囊泡的仿生骨支架系统促进了宿主血管的生长,加速了桡骨的再生。此外,还在植入后 12 周进行了免疫组化染色(BMP-2、Runx2 和 OCN),以研究骨再生过程中可能存在的成骨相关表达(图 5C-E)。定量分析显示,在 PCLMA-BAS-ENs 组中,BMP-2、Runx2 和 OCN 的骨相关表达水平均有所提高(图 5F)。总之,这些结果表明,负载 ENs 的仿生骨支架可以调节体内局部成骨微环境,促进骨再生和修复。
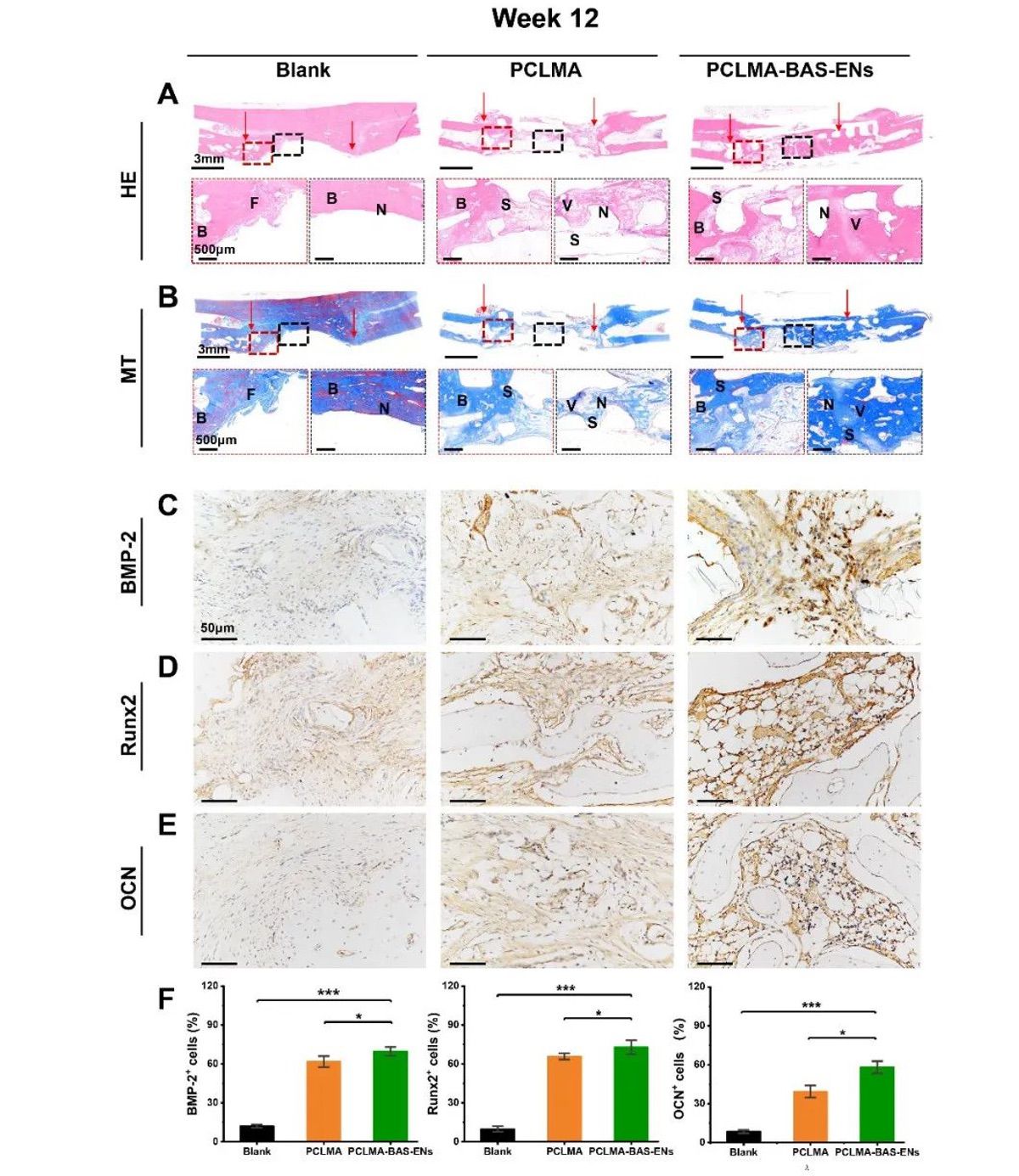
图4 PCLMA-BAS-ENs支架修复兔骨缺损的实验研究
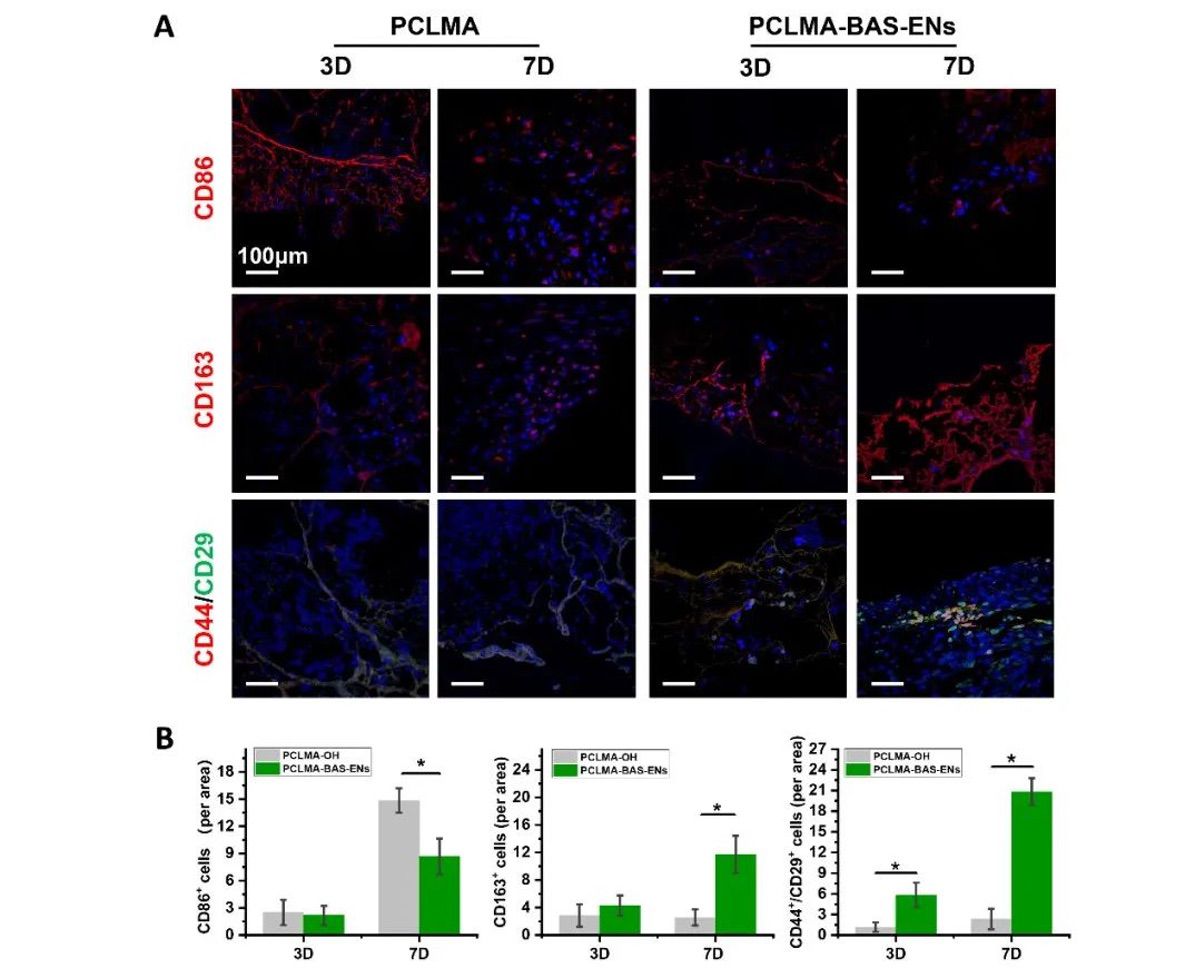
图5 第12周时再生组织的代表性染色图像
【仿生骨诱导支架对局部成骨微环境的调节】
有研究表明,组织缺损部位局部微环境调控的关键时期是创伤发生后的三天内。作者在第3天收集植入兔子骨缺损部位的支架,包括3个负载囊泡的支架(PCLMA-BAS-ENs 组)和3个装有纯材料的支架(PCLMA 组),并洗脱支架表面的蛋白质进行蛋白质组学分析。本研究根据定量蛋白质组学和 DIA 的显著性标准(FC > 1.2,P < 0.05)鉴定了857个上调蛋白质和37个下调蛋白质,并将数据以火山图(图 7A)和直方图(图 7B)的形式呈现。KEGG 通路分析揭示了差异表达的蛋白质。更具体地说,前20个蛋白质富集在多个生物学过程中,如氧化磷酸化、cAMP 信号通路、cGMP-PKG 信号通路、白细胞跨内皮迁移、趋化因子信号通路等(图 7C)。同时,GO 富集分析表明,差异蛋白参与了细胞对干扰素-γ 的反应、氧化还原过程、正趋化作用、对表皮生长因子的反应、中性粒细胞趋化作用的正调控等(图 7D-F)。为了进一步阐明仿生支架促进成骨的细胞学机制,分别在第3天和第7天对 PCLMA-BAS-ENs 组和 PCLMA 组(n = 6)进行了免疫荧光染色,定量结果显示,在第7天、 M1型巨噬细胞相关标记物CD86在PCLMA-BAS-ENs组的表达水平低于PCLMA组,而M2型巨噬细胞相关标记物CD163在PCLMA组的表达水平低于PCLMA组。此外,在第 7 天,PCLMA-BAS-ENs 组的 rBMSC 相关标记物 CD44 和 CD29 的表达水平也明显高于 PCLMA 组,而且可以明显观察到骨髓间充质干细胞聚集(图 6A 和 B)。
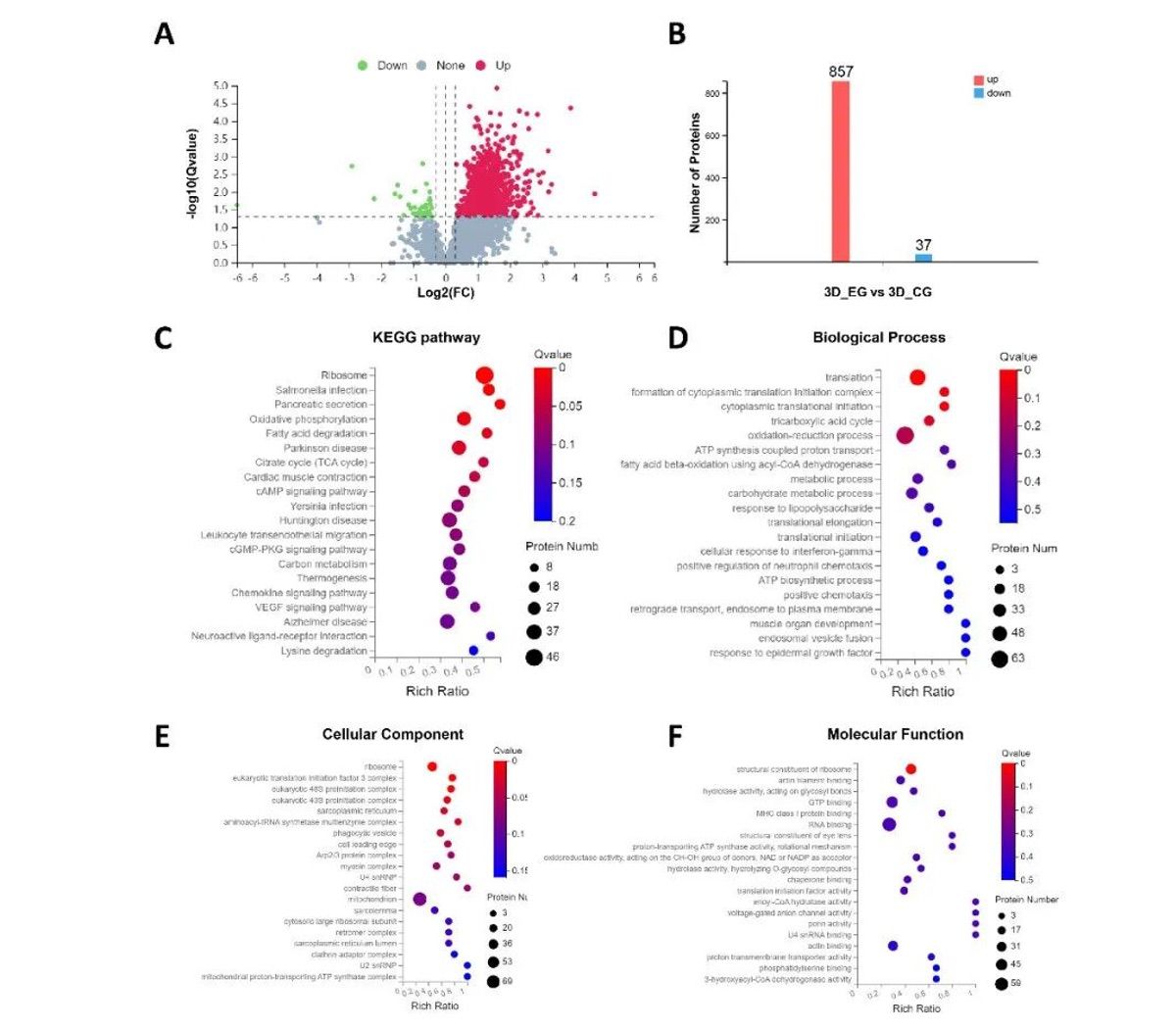
图6 仿生骨诱导支架的免疫调节和干细胞募集
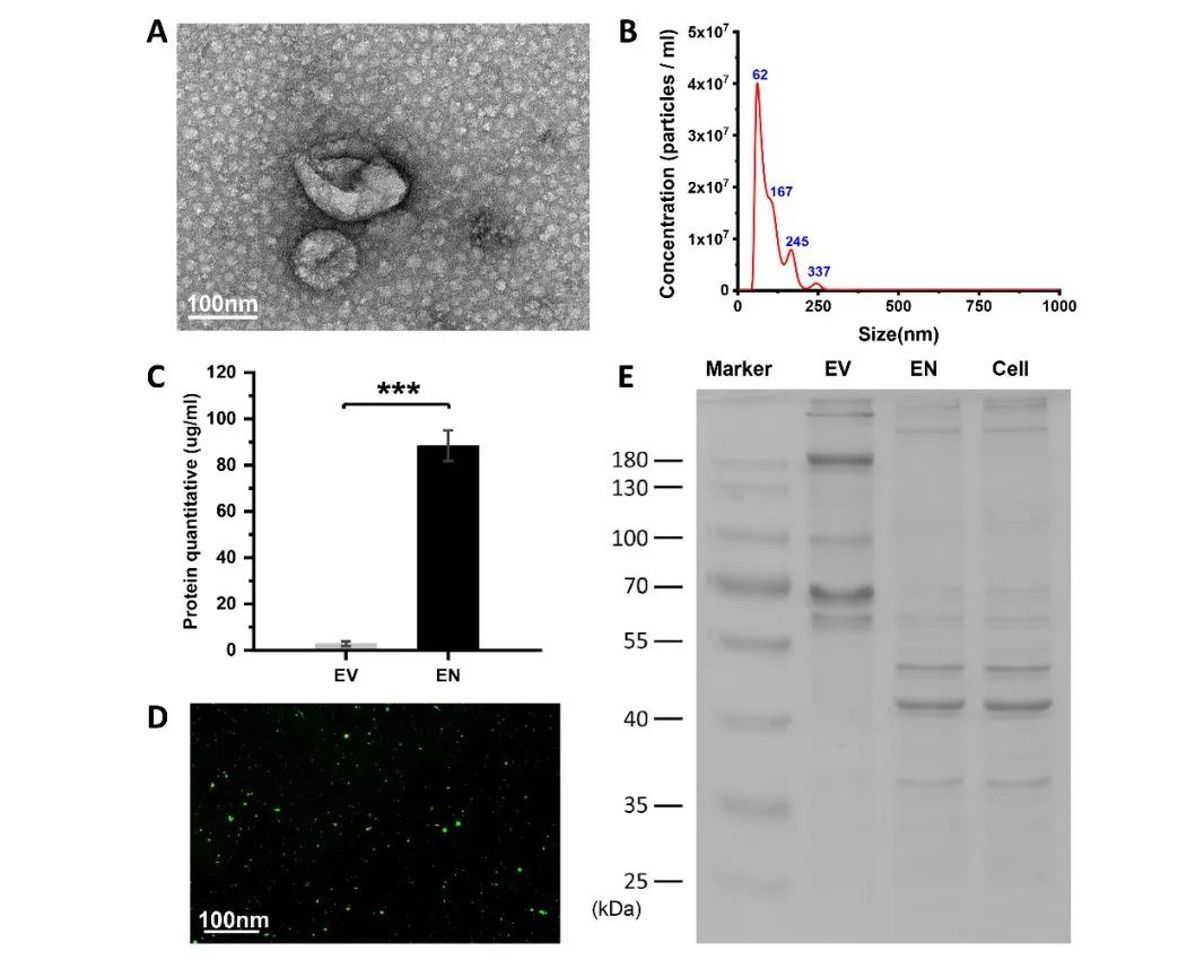
图7 仿生骨诱导支架对局部成骨微环境的影响的调控机制
2. 总结与展望
本研究成功地利用投影式光固化3D打印技术制备了高精度的仿生骨支架,并通过灌流装置将生物素标记的ENs移植到其上。这种精心设计的仿生支架负载丰富的工程化纳米囊泡,建立了一个有利于成骨的微环境。体内实验进一步证实了其促进大段骨缺损修复的能力,可归因于其早期的免疫调节、促进血管生成和促进成骨反应。因此,本研究为功能化高精度仿生支架的研究提供了一种有前景的策略,为骨缺损微环境的局部调控铺平了道路。
文章来源:
https://doi.org/10.1016/j.biomaterials.2024.122566
(责任编辑:admin)
最新内容
热点内容


 CNES引入INTAMSYS聚合物FF
CNES引入INTAMSYS聚合物FF 具有显著纵波传播特性的三
具有显著纵波传播特性的三 生物3D打印、类器官应用,
生物3D打印、类器官应用, MIT新突破:无需半导体也
MIT新突破:无需半导体也 亚马逊和Holcim投资14Tree
亚马逊和Holcim投资14Tree 回收SLS 3D打印尼龙废料,
回收SLS 3D打印尼龙废料, 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强 《Science》:一
《Science》:一 国产大尺寸陶瓷3D
国产大尺寸陶瓷3D 南京工业大学:基
南京工业大学:基

