哈佛医学院Y. Shrike Zhang教授课题组AHM:同轴3D生物打印多发性骨髓瘤模型
时间:2021-09-28 08:25 来源:高分子科技 作者:admin 阅读:次
近日,哈佛大学医学院Y. Shrike Zhang教授课题组通过同轴挤压生物打印方法形成一个类似人骨髓的微环境、制备了体外多发性骨髓瘤(Multiple
Myeloma,
MM)模型。该模型外部为含有骨矿物质羟基磷灰石的外鞘,内部则含有水凝胶内核(图1)。MM细胞被单独培养或与能够释放白介素-6(IL-6))的HS-5基质细胞共培养,这些细胞在3D模型中表现出比2D平面培养更优越的增殖功能(图2)。Dana-Farber肿瘤研究所提供的患者来源的MM细胞可以在3D生物打印模型中维持良好的生存能力长达7天甚至更久,而在2D平面培养中它们在3-5天内就会完全死亡。
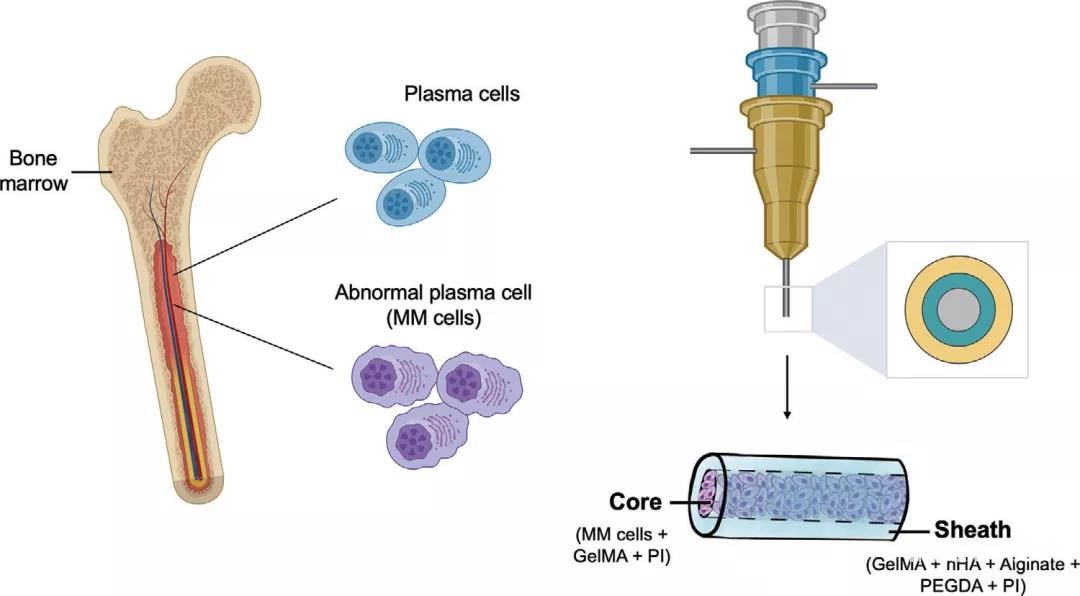
图1. MM的体内环境和同轴生物打印高内涵MM体外模型的示意图。
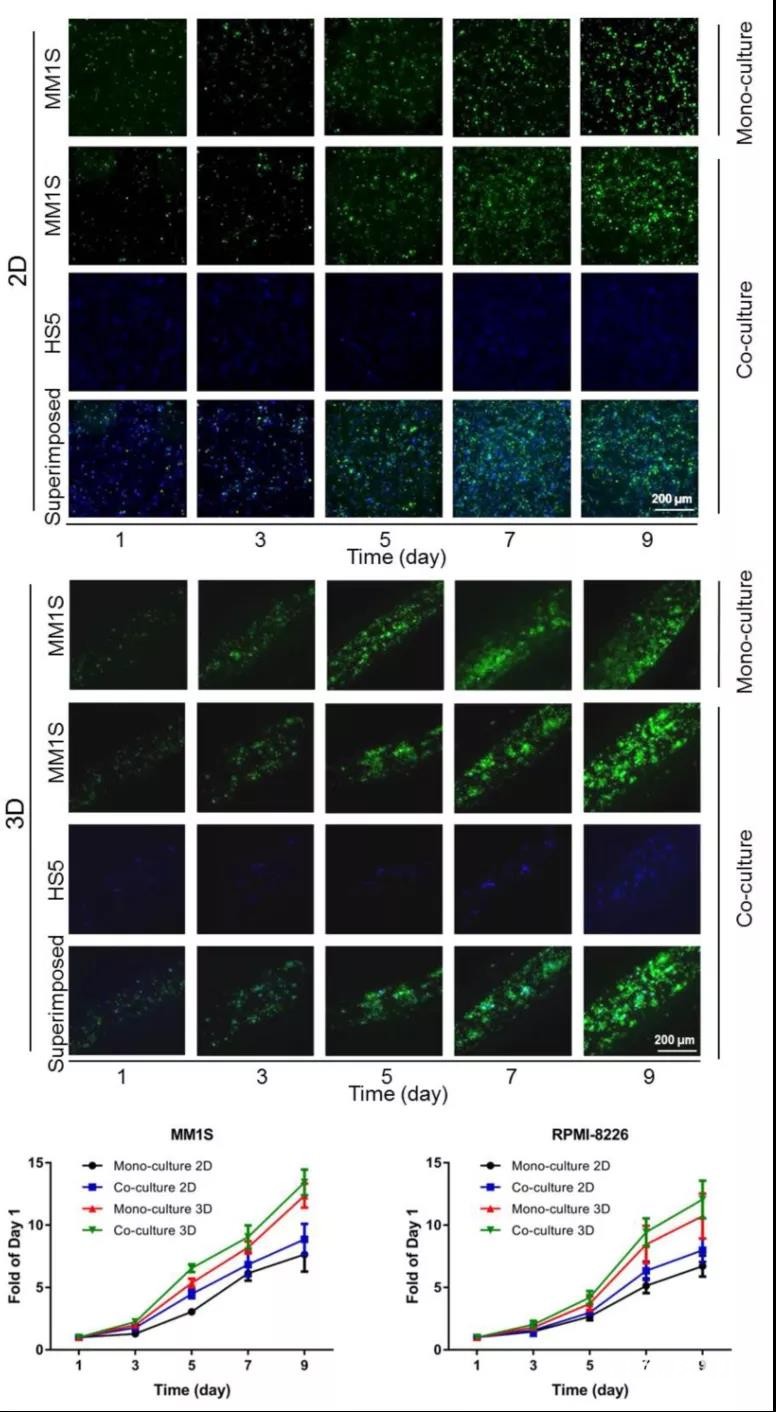
图2. 2D和3D系统中MM细胞(MM1S细胞和RPMI-8226细胞)单独培养或与HS5基质细胞共培养条件下的细胞增殖情况。
硼替佐米(bortezomib,
BTZ)作为一线抗肿瘤药,于2004年被引入后极大地改变了MM治疗的状况,现在几乎所有骨髓瘤患者在治疗过程中都会接受BTZ治疗。与其他药物相比,BTZ可以诱导更深的反应,导致更高的反应率,并延长新诊断MM或复发MM患者的生存时间。3D生物打印的MM模型有效重现了BTZ对MM细胞增殖的抑制,并筛选出最佳浓度(图3)。
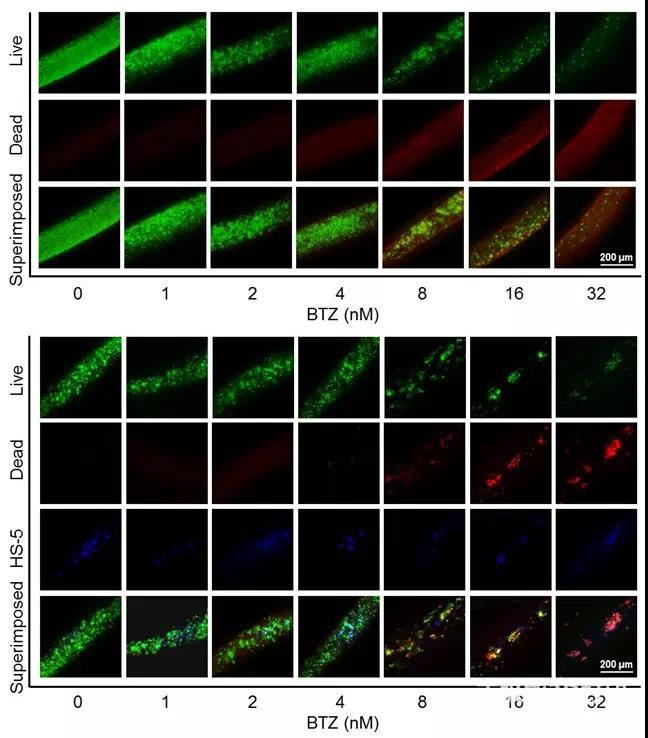
图3. 3D单独和共培养系统中BTZ抑制MM细胞增殖的情况。
不幸的是,BTZ也与一些毒副作用有关,如血液病、疲劳、胃肠不适和周围神经病变。更糟糕的是,几乎所有的患者都会对BTZ产生耐药性。因此,为了改善MM的治疗,必须对BTZ的耐药性进行表征、研究并最终解决。托珠单抗(Tocilizumab,
TOC)是一种重组人源化抗IL-6受体(IL-6R),研究人员通过TOC抑制IL-6R与IL-6的结合,从而增强BTZ对3D模型培养的MM细胞的化疗敏感性(图4)。
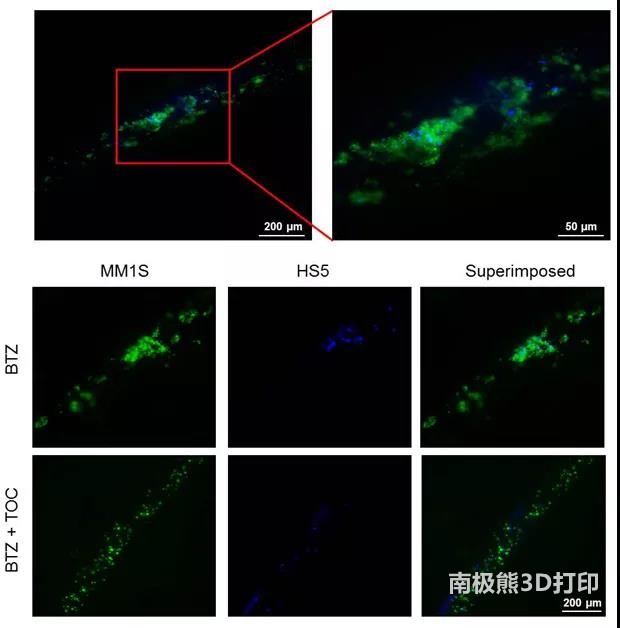
图4. 3D模型中TOC抑制MM细胞聚集,增强BTZ疗效。
综上所述,研究人员制备了一个3D生物打印的MM模型,模拟了人骨髓的一些特性,以促进被封装的MM细胞的生长和增殖,同时在此模型中联用BTZ和TOC抑制骨髓瘤细胞的增殖,为未来的MM建模、药物开发和个性化治疗提供了新的见解。
该研究成果以“A 3D-Bioprinted Multiple MyelomaModel”为题发表在Advanced Healthcare Materials上。哈佛医学院/北京协和医院联合培养博士吴狄,哈佛医学院/上海交通大学医学院联合培养博士王棕逸,哈佛医学院/华西医院联合培养博士李军以及Dana-Farber肿瘤研究所宋燕博士为论文的共同第一作者。通讯作者为哈佛医学院Y.
Shrike Zhang教授,哈佛大学Dana-Farber肿瘤研究所Kenneth C. Anderson教授和Dharminder
Chauhan教授为共同通讯作者。论文的其他作者还包括哈佛医学院Manuel Everardo Mondragon
Perez、王子萱、曹霞教授、曹长靓博士和Sushila Maharjan博士后。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adhm.202100884
作者简介:
Y. Shrike Zhang:博士,美国哈佛大学医学院助理教授,2013年于Georgia
Institute of
Technology生物医学工程系取得博士学位。研究领域包括生物打印及器官芯片的平台搭建与应用研究,在相关领域发表研究论文及综述250余篇,包括以第一或通讯作者发表的PNAS、Science、Nat.
Rev. Mater.、Nat. Rev. Nephrol.、Nat. Rev. Methods Primers、Appl. Phys.
Rev.、Nat. Commun.、Matter、Adv. Mater.、ACSNano、Angew. Chem. Int.
Ed.、Biomaterials等,其中超过45篇封面文章;研究成果曾被BBC、Fox News、The Boston Globe/STAT
News、Science Daily、Technology Networks、IEEE
Spectrum、C&EN等报道。担任20余本杂志的主编、副主编或编委,曾获得多种国际和地区性奖项40余项。
(责任编辑:admin)
最新内容
热点内容


 CONTEXT最新市场报告:入
CONTEXT最新市场报告:入 增材制造研究报告:钛粉市
增材制造研究报告:钛粉市 AM Research报告:2024年
AM Research报告:2024年 生物打印前沿:奥地利初创
生物打印前沿:奥地利初创 瑞典初创企业Nobula接受3D
瑞典初创企业Nobula接受3D 到2033年,陶瓷3D打印市场
到2033年,陶瓷3D打印市场 中南大学在增材制
中南大学在增材制 美国应用科学技术
美国应用科学技术 2023年美国3D打印
2023年美国3D打印 浅谈3D打印技术的
浅谈3D打印技术的 据SmarTech评估,
据SmarTech评估, 12位福布斯技术专
12位福布斯技术专

