通过同轴牺牲打印将仿生血管网络嵌入功能组织
时间:2024-09-30 14:37 来源: EFL生物3D打印与生物制造 作者:admin 阅读:次
打印充满仿生血管网络的人体组织和器官越来越引起人们的兴趣。虽然可以在非细胞和密集细胞基质中嵌入可灌注通道,但目前还不具有在天然血管中发现的仿生结构。近日,美国哈佛大学Jennifer A. Lewis、Sebastien G.M. Uzel开发了一种嵌入式生物打印方法—同轴牺牲写入功能组织(co-SWIFT),能够在颗粒状水凝胶和密集的细胞基质中产生分层分支的多层血管网络。在同轴打印头部设计了扩展的核壳配置,以促进在嵌入式生物打印期间打印分支血管之间强大的核-核和壳相互连接。使用优化的核壳油墨组合,仿生血管由一个充满平滑肌细胞的外壳组成,围绕着可灌注的管腔,被同轴打印成颗粒基质,由:1)透明的海藻酸盐微粒,2)牺牲的含微粒的胶原蛋白,或3)来自人诱导多能干细胞的心脏球状体组成。具有良好屏障功能的仿生血管通过在这些相互连接的管腔内植入一层融合的内皮细胞而产生。研究发现,co-SWIFT心脏组织在灌注下成熟,同步跳动,并在体外表现出对心脏有效的药物反应。本研究为用于药物测试、疾病建模和治疗使用的可扩展的生物制造开辟了新途径。
相关研究内容以“Embedding Biomimetic Vascular Networks via Coaxial Sacrificial Writing into Functional Tissue”为题于2024年8月2日发表在《Advanced Materials》。
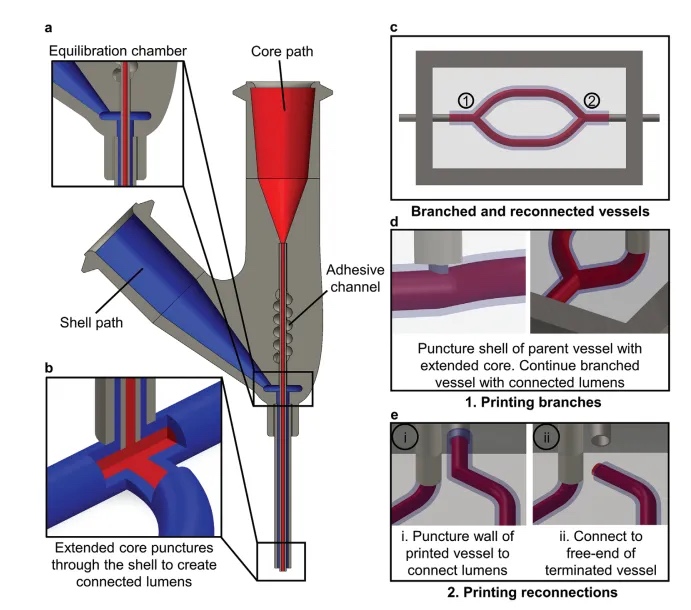
图1 功能组织中的同轴牺牲书写(co-SWIFT)
本研究首先设计了一种新型的同轴打印头,由一个扩展的核壳喷嘴和两个独立可控的核和壳油墨流体路径组成(图1a)。将核心喷嘴延伸到外壳喷嘴之外,这对于确保同轴喷嘴刺穿壳层在分支和重新连接过程中形成母血管之间的核-核和壳-壳连接至关重要(图1b-e)。可以使用扩展的核心来刺穿丝状特征的壳壁以创建一个分支点(图1d)。在挤压核和壳油墨时,再次使用扩展的核喷嘴刺穿打印细丝的壳体(图1e i)。也可以通过以类似的方式连接打印的同轴灯丝的活动端来形成连接(图1e ii)。依次进行同轴互连以建立越来越复杂的分支血管网络。

图2 co-SWIFT的核、壳和矩阵优化
本研究制定了牺牲品明胶核油墨,使其剪切变薄行为和τy≈50 Pa与颗粒状海藻酸盐基质相匹配(图2a)。每个核-壳油墨组合都可以在这个矩阵的垂直方向上成功打印(图2b)。为了模拟天然的血管系统,本研究打印了不同直径的同轴血管,它们具有符合Murray定律的三代分支特征(图2c)。图2d显示了打印血管的横断面图像,在每一代中都保持同轴核-壳结构。为了制备总直径大于3 mm到小于1 mm的血管,改变打印速度的同时以恒定的体积流量挤压核和壳油墨(图2e)。
图3 打印仿生血管的内皮化
嵌入的血管由具有三维模式且符合Murray定律的一个分层的分支网络组成(图3a-c)。打印后,将组织结构加热到37°C,以促进壳状胶墨和μPOROS基质中的胶原凝胶化并交联,同时熔化牺牲的明胶核心(红色)(图3b)。将带血管化的基质灌注PBS(蓝色),以显示其相互连接的管腔网络(图3c)。为进一步提高生理相关性,本研究打印了一个仿生血管网络,含SMC的壳墨水组成,围绕着μPOROS基质中牺牲的明胶核心墨水(图3d)。灌注第7天,平滑肌细胞保持存活、扩散并环绕血管壁,类似于原生内侧层的形态(图3e、f)。内皮细胞排列在一个融合的单层中,并伴有粘附的连接(图3g-i)。然后进行Miles实验来评估其屏障功能,结果显示:与裸(对照组)血管相比,具有融合内皮的血管中的染料扩散减少3倍(图3j)。
图4 通过co-SWIFT制造血管化的心脏组织
本研究使用离心法将心脏器官构建块(OBBs)挤进到一个密集的细胞粘弹性基质中(图4a)。首先制作了圆柱形心脏组织,其中有一个嵌入的核壳血管,悬挂在弹簧臂之间(图4a-h)。与SWIFT相比,co-SWIFT心脏组织的血管腔圆度值高出近两倍(图4b、c)。灌注一天后,对co-SWIFT速心脏组织进行活-死实验,结果显示它们在整个横截面上具有较高的细胞活力(图4d)。灌注第7天,包埋的血管由一层被平滑肌细胞包围的融合的内皮细胞组成(图4e)。灌注第5天,co-SWIFT心脏组织开始同步收缩(图4f)。重要的是,这些组织也表现出对心脏有效的药物反应。在灌注浓度为10×10−6M的含异丙(去甲)肾上腺素的含氧培养基培养后,观察到它们的自发跳动频率翻倍。相比之下,含有10×10−6M blebbistatin介质的灌注可抑制这些心脏组织的跳动(图4g、h)。为进行可视化,本研究将初始分支和完整的动脉结构打印到透明海藻酸盐基质和密集细胞的心脏OBB基质中(图4j-k)。
全文小结
总之,本研究建立了第一个基于同轴的生物打印方法,能够将分支、多层血管网络嵌入到脱细胞和密集的细胞组织基质中。为证明广泛的适用性,本研究定制了核、壳和基质材料的流变学特性,用于在颗粒状藻酸盐、微孔结构胶原和心脏球状基质中打印。通过设计、制造和实现定制的扩展核壳喷嘴,证明了可以产生由围绕牺牲核心油墨的负载平滑肌细胞壳式油墨组成的分层分支血管。这种网络具有相互连接的腔,这些腔被平滑肌细胞包裹,并植入内皮细胞,形成融合的内皮,提供良好的屏障功能。最后,本研究创建了嵌入仿生血管的心脏组织,其设计以患者特异性数据为指导。本研究工作为在软、活组织结构中嵌入仿生血管网络提供可能。
文章来源:
https://doi.org/10.1002/adma.202401528
(责任编辑:admin)
最新内容
热点内容


 中南大学:增材制备可生物
中南大学:增材制备可生物 2024年二季度,中国3D打印
2024年二季度,中国3D打印 《Bioactive Materials》
《Bioactive Materials》 增材制造中机器学习研究综
增材制造中机器学习研究综 高性能水凝胶的3D生物打印
高性能水凝胶的3D生物打印 研究人员开创使用X射线和
研究人员开创使用X射线和 选区激光熔化增材
选区激光熔化增材 大型聚合物3D打印
大型聚合物3D打印 6K Additive最新
6K Additive最新 如何打造增材制造
如何打造增材制造 从实验室走向生产
从实验室走向生产 3D打印在口腔修复
3D打印在口腔修复

