武汉大学药学院黎威教授课题组:可穿戴式自供电微针贴片用于增强深部黑色素瘤治疗
时间:2023-12-27 11:08 来源:摩方精密 作者:admin 阅读:次
基于此,武汉大学药学院黎威教授和姜鹏副教授课题组设计开发了一种集成柔性摩擦电纳米发电机(F-TENG)的可穿戴自供电载药微针(MNs)贴片,旨在增强深部黑色素瘤的治疗。微针由水溶性微针基质材料与带负电荷的pH响应纳米粒子(NPs)混合而成,其中纳米粒子中装载着治疗药物。该装置充分利用MNs和F-TENG的优势(F-TENG能够利用个人机械运动产生电能),治疗性NPs可以在MNs贴片插入皮肤后渗透到深层部位,在酸性肿瘤组织中迅速释放药物。在深部黑色素瘤小鼠模型对比实验中,使用集成的F-MNs贴片的治疗效果优于普通MNs贴片,预示这集成F-MNs贴片在深部肿瘤治疗的巨大潜力。
该贴片通过摩方精密microArch® S240(10μm精度)制备完成,相关研究成果以题为“Enhancing Deep-Seated Melanoma Therapy through Wearable Self-Powered Microneedle Patch”的文章发表在《Advanced Materials》。武汉大学药学院博士研究生王陈媛、硕士研究生何光琴和博士研究生赵环环为共同第一作者,武汉大学药学院黎威教授和姜鹏副教授为共同通讯作者。

首先,研究者采用气体扩散法合成了具有pH响应性质的Ce6@CaCO3 NPs, Ce6@CaCO3 NPs为100 nm左右均匀分布的球形结构,表面修饰PEG进一步增强纳米粒子的胶体稳定性。在pH = 7.4的中性环境中,纳米粒子维持稳定的结构,使得封装的药物难以释放。在pH = 5.5的酸性环境中,纳米粒子结构被破坏,可实现药物的快速释放(如图1)。
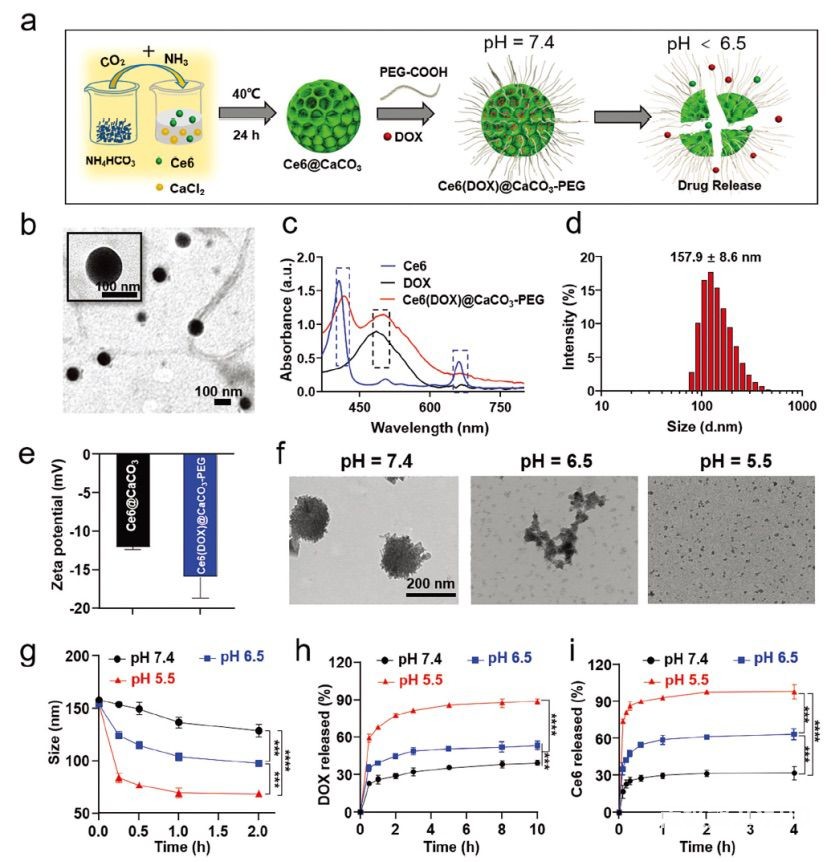
图1 Ce6(DOX)@CaCO3-PEG NPs的合成与表征a)
Ce6(DOX)@CaCO3-PEG NPs的合成和药物释放过程示意图。b)合成Ce6@CaCO3
NPs的TEM图像。c)游离Ce6、游离DOX和Ce6(DOX)@CaCO3-PEG的紫外可见光谱(蓝色和黑色虚线矩形分别表示Ce6和DOX的特征吸收峰)。d)
DLS测定的Ce6(DOX)@CaCO3-PEG NPs的粒径分布。e) Ce6@CaCO3和Ce6(DOX)@CaCO3-PEG
NPs的Zeta电位。f) Ce6(DOX)@CaCO3-PEG NPs在不同pH值(7.4、6.5和5.5)的PBS中孵育0.5
h后的代表性TEM图像。g) Ce6(DOX)@CaCO3-PEG
NPs在不同pH值(7.4、6.5和5.5)的PBS中随时间变化的水动力直径变化。Ce6(DOX)@CaCO3-PEG
NPs在不同pH值PBS中h) DOX或i) Ce6的体外释放谱。每个点代表平均值±SD (n = 3个独立重复实验)。***p <
0.001, ****p < 0.0001。
随后,作者在细胞上验证了纳米粒子的抗肿瘤疗效。药物被纳米粒子包封后显著增强了细胞对药物的摄取。除此之外,纳米粒子结合Ce6的光动力和DOX的化疗疗效,实现了光动力和化疗联合治疗的抗肿瘤疗效,其效果显著优于单一光动力或者化学疗法(如图2)。
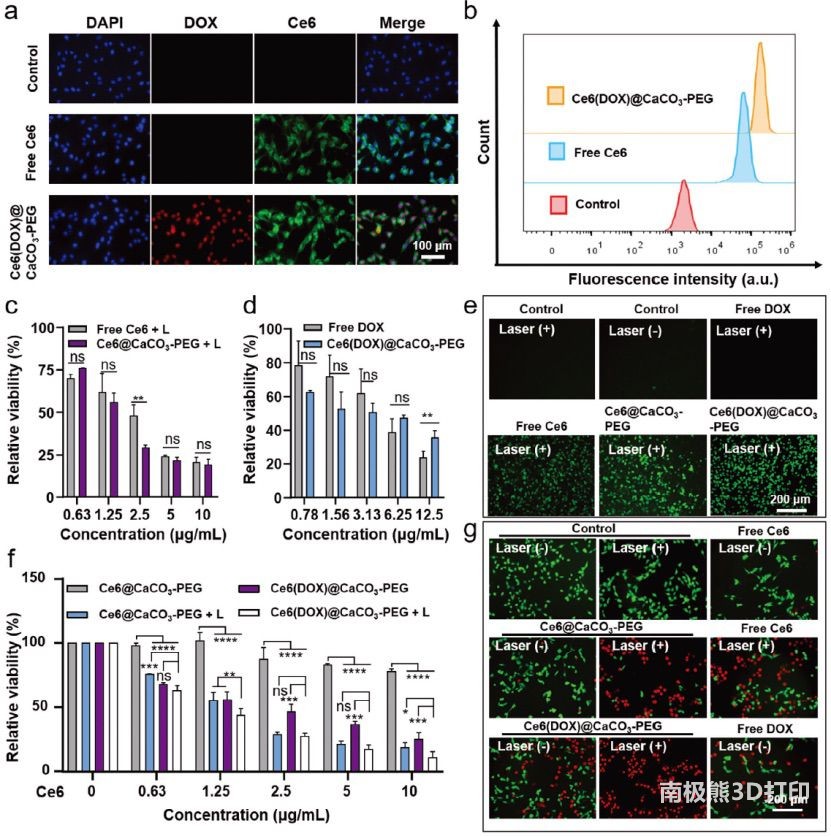
图2 Ce6(DOX)@CaCO3-PEG NPs的体外行为a)
B16-F10细胞对Ce6(DOX)@CaCO3-PEG NPs的摄取。b) Ce6(DOX)@CaCO3-PEG NPs孵育4
h后细胞摄取量的定量测定c)激光照射下游离Ce6或Ce6@CaCO3-PEG孵育后B16-F10细胞的细胞活力。两种处理的Ce6浓度相当。d)游离DOX或Ce6(DOX)@CaCO3-PEG孵育后B16-F10细胞的细胞活力。两种处理的DOX浓度相当。e)
660 nm激光照射不同处理下B16-F10细胞内ROS检测。f)用Ce6@CaCO3-PEG或Ce6(DOX)@CaCO3-PEG
NPs处理B16-F10细胞在激光照射或不照射下的细胞活力。g)不同处理后B16-F10细胞的活/死测定。这些处理具有相同的DOX或Ce6浓度。绿色荧光:钙素-AM;红色荧光:碘化丙啶(PI)。每个点代表平均值±SD
(n = 3个独立重复实验)。*p < 0.05, **p < 0.01, ***p < 0.001. ns表示无显著性。
同时,研究者通过硅橡胶和导电织物制备了一种典型的接触和分离模式的柔性摩擦电层F-TENG,可以通过接触通电和静电感应的耦合效应将生物机械能转化为交流电(AC)输出。然而,为了有效地为离子电泳系统供电,交流输出必须转换成直流(DC)。因此,作者制作了电源管理系统(PMS),将F-TENG的交流转换为直流,同时显著放大电流。最后将柔性的F-TENG与载药微针结合,制备成一种可穿戴的装置(如图3)。
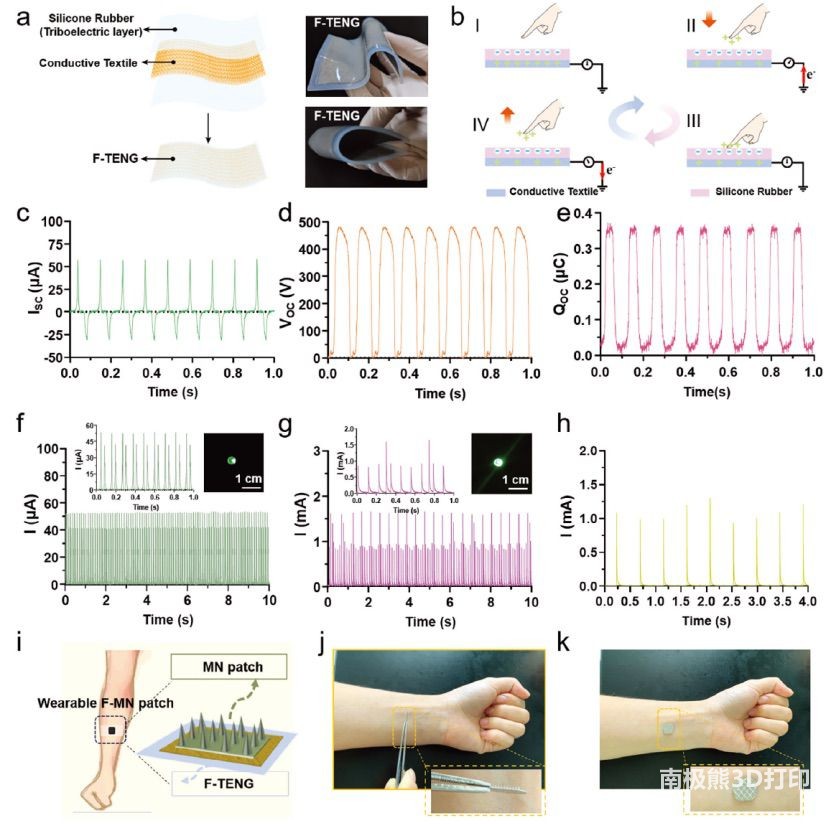
图3 一种工作在接触分离模式下的柔性TENG (F-TENG)。a)
F-TENG的原理图(左)和照片(右)。b) F-TENG工作机理示意图。c)短路电流,d)开路电压,e)
F-TENG的转移电荷。f)连接整流桥和LED灯的F-TENG输出电流。g)连接电源管理系统和LED灯的F-TENG输出电流。(f)和(g)中的插图是15秒内电流峰值的放大视图和LED灯的光学照片。h)手动驱动F-TENG连接到PMS的电流。i)可穿戴式F-MN贴片原理图。可穿戴的F-MN贴片j)贴在人体手臂上之前和k)贴在没有皮肤穿刺的情况下的演示照片。
微针通过真空浇筑法,将载药的纳米粒子与水溶性基质PVA/suc混合后填入PDMS模具中制备得到,并用导电的PPy作为微针背衬填入。制备好的微针与F-TENG通过导电胶连接得到F-MN装置。此外,将偶联FITC荧光的葡聚糖作为模型药物被微针递送到到皮肤后,通过荧光分布可以看出连接F-TENG的微针装置具有更高效和深部的药物递送(如图4)。
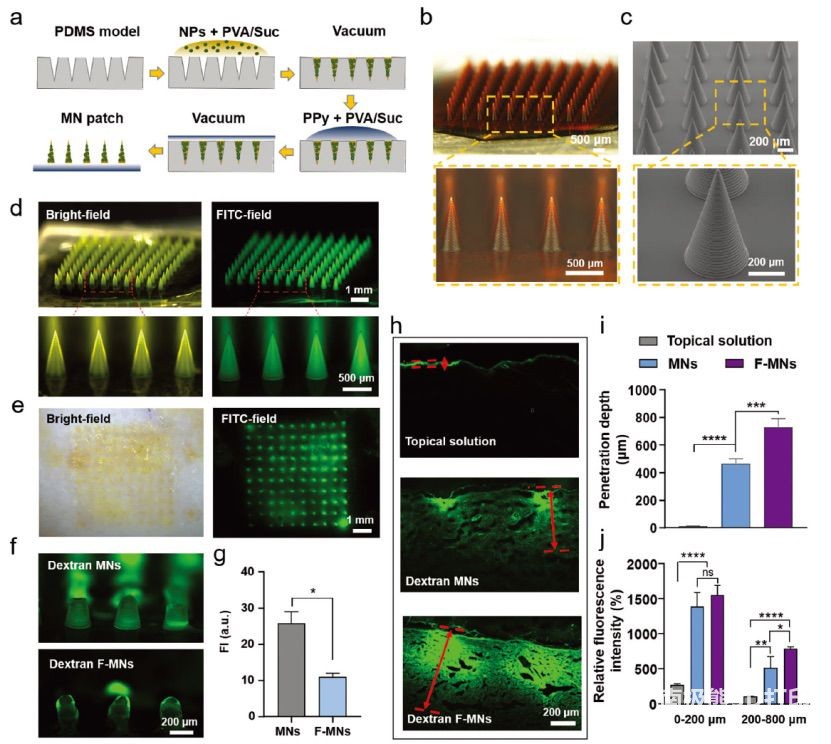
图4 F-MN贴片的制备与表征。a)
MN贴片制作工艺示意图。b)制备的MN贴片的光学图像和c) SEM图像。d) FITC
-葡聚糖负载MN贴片的代表性明场(左)和荧光显微镜图像(右)。e)右旋糖酐-MN贴片插入后大鼠皮肤代表性明场和荧光显微镜图像。f)荧光图像和g)植入或不植入F-TENG的大鼠皮肤后残余MNs的相应荧光强度(FI)。h)代表性显微镜图像,i)药物穿透深度,j)外用葡聚糖溶液或葡聚糖-MN贴片加F-TENG或不加F-TENG后大鼠皮肤组织切片对应的荧光强度。每个点代表平均值±SD
(n = 3个独立重复实验)。*p < 0.05, **p < 0.01, ***p < 0.001, ****p <
0.0001. ns表示无显著性。微针尺寸:高850 μm,尖端直径10 μm,底座直径400 μm.
(责任编辑:admin)
最新内容
热点内容


 中南大学:增材制备可生物
中南大学:增材制备可生物 2024年二季度,中国3D打印
2024年二季度,中国3D打印 《Bioactive Materials》
《Bioactive Materials》 增材制造中机器学习研究综
增材制造中机器学习研究综 高性能水凝胶的3D生物打印
高性能水凝胶的3D生物打印 研究人员开创使用X射线和
研究人员开创使用X射线和 选区激光熔化增材
选区激光熔化增材 大型聚合物3D打印
大型聚合物3D打印 6K Additive最新
6K Additive最新 如何打造增材制造
如何打造增材制造 从实验室走向生产
从实验室走向生产 3D打印在口腔修复
3D打印在口腔修复

