Biomaterials science:牛津大学工程科学系生物医学工程研究所江卓然博士在具有功能...
时间:2024-10-23 08:53 来源:南极熊 作者:admin 阅读:次

一、背景介绍
生物打印旨在使用特定的活细胞制造生物活性组织或器官,用于治疗疾病或测试方式 。人们在设计细胞类型、细胞材料生态位和再生方法方面做出了广泛的努力。然而,直接打印载有细胞的生物墨水以在体外重建功能和结构完整的器官或组织可能是一项挑战。传统上,采用基于挤出的生物打印,其中载有细胞的生物墨水逐层打印。此过程不可避免地限制了打印量和细胞数。生物墨水的开发工作试图通过改变墨水材料的化学和流变特性来增强细丝的自跨越能力,以实现体积增量。不幸的是,这种方法通常会损害细胞性能。为了克服这些限制,嵌入式打印(涉及在抵消重力和表面张力的支撑介质中进行3D打印)已被应用于打印组织、软机器人、生物传感器和医疗设备。这种替代方法允许设计和构建精的细体内结构(如脉管系统和空化)。除了设计自上而下的生物制造方法外,还必须正确选择特定的细胞来源,以便再生目标组织或器官。
将自上而下的嵌入式生物打印与自下而上的细胞自组织相结合的最新进展导致了厚血管化组织的发展。血管化的心脏组织由于其固有的血管层次结构而具有特别的兴趣。尽管这些进步代表了器官打印的重大进展,但它们在体外和体内同时维持细胞功能和复制组织结构的能力有限,从而限制了它们作为移植替代品的潜力。此外,心脏和肠道等空心器官比肝和肾等实质器官更容易构建,因为实质器官执行完整的生理功能,需要适当的细胞资源、完整的细胞-细胞外基质(ECM)整合和血管化。例如,肝细胞群由实质细胞和非实质细胞组成。肝细胞约占总体肝脏细胞的70 %,并执行肝脏的主要生理功能。由于肝脏的复杂性,肝脏3D打印的大多数研究都集中在用于术前可视化的脱细胞手术模型重建上。在3D自组装的微型肝脏中发现其延长了小鼠肝衰竭模型的存活率。这项研究推进了3D肝组织作为肝脏疾病的治疗选择。
在这项研究中,旨在使用自组织肝细胞构建块通过嵌入式生物打印构建三维、功能性和可移植的肝球状体封装人工肝脏(HEALs)。嵌入式打印程序包括两个步骤:在支撑物内挤出油墨以形成设计结构,然后去除支撑介质以保持所需的结构。去除步骤通常很难在不破坏打印结构的情况下进行,尤其是当打印件具有精细的脉管系统结构时。为了实现复杂的器官打印,开发了一种基于疏水相互作用的聚合物网络作为支持介质。提出的支持介质称为全向打印嵌入式网络(OPEN),其主要特点包括:制备简单、直接去除支撑物以及与不同生物墨水的兼容性,同时保持支撑稳定性、精确打印能力和生物相容性(图 1A)。然后将明胶-甲基丙烯酸酯(GelMA)与OPEN结合,以创建用于组织重建的载细胞打印件。使用原代小鼠肝细胞(PMH)作为肝功能重建的肝细胞组成部分,其来源培养基可以在体外诱导肝球状体形成。为了创建载有细胞的静脉结构并诱导移植后血管形成,小鼠内皮细胞系C166作为静脉生物墨水封装在GelMA中(图1B和C)。所得打印的肝脏称为HEAL (图1D)。每个HEAL层的打印路径都是根据节段肝脏解剖结构预先设计的,因此双喷嘴打印可以相应地准确地重建肝脏段和静脉(图1E)。在体外证明了功能性肝细胞球体的形成以及标志物蛋白表达和肝功能。此外,与传统肝细胞培养物相比,打印的肝球体的基因表达与新鲜分离的PMH表现出更好的相似性,这意味着在原位肝移植中使用HEAL的潜力更高。我们还证明HEALs是可移植的,并且可以通过募集内皮细胞和生长因子显着诱导内源性新生血管形成。

图1 .通过嵌入式3D打印实现可移植和生物活性的微型肝脏。(A)利用Pluronic® F-127(PF127)和疏水改性羟丙基甲基纤维素(H-HPMC)之间的疏水结合的一步法OPEN制备的示意图。(B)PMH的分离、2D增殖以及PMH和C166的配对生物墨水制备。(C)从体外异质性嵌入生物打印到体内移植的生物活性微型肝再生过程的逐步表示。(D)用红色或象牙色染料染色的印刷结构的图像。(i)HEAL的前视图,包含一个格子状的迷你肝脏和圆柱形静脉。(ii)静脉系统的前视图,包括门静脉和肝静脉。(iii)HEAL的无静脉打印层的俯视图。比例尺,20毫米。(E) OPEN中HEAL打印的示意图。PMHs和C166分化为成熟的肝球状体和汇合的内皮细胞。
二、方法
2.1 嵌入网络、洗涤剂和油墨制备
为了产生OPEN,将12.5 wt% Pluronic® F-127(PF127,Sigma-Aldrich)在4 °C下溶于磷酸盐缓冲盐水(PBS)中过夜,直至完全溶解。将2.5 wt%疏水改性羟丙基甲基纤维素(H-HPMC)(Sangelose 90L,Daido Chemical Co.)逐渐加入液体PF127中,并在冰浴中剧烈搅拌。将混合物移到50 mL锥形管中,并以大约1000 rpm 的速度离心1分钟以去除气泡。混合物被小心地转移到丙烯酸盒中作为打印室。将 α-环糊精(a-CD)粉末在PBS中剧烈搅拌下溶解,作为配对的聚合物去除材料。对于OPEN中的生物打印,在混合或进一步使用之前,通过0.22 μm过滤器对12.5 wt% PF127溶液和5 wt% a-CD溶液进行灭菌。2.5 wt% H-HPMC 粉末和丙烯酸盒在紫外线(UV)下照射过夜。向冻干的GelMA聚合物(SunP Gel G1,SunP Biotech Co.)中加入无菌盐水制备12.5 wt% GelMA,并将其置于70 °C水浴中直至完全溶解。液化的GelMA通过0.22 μm过滤器进行灭菌,然后分装到Eppendorf 管中,在4 °C下储存。
2.2 流变测量
OPEN 的流变学特性是在旋转流变仪(Discovery HR-2、TA仪器)上使用50 μm间隙和直径为40 mm的平行板获得的。将样品转移到测试板上,以2 °C/min的速度从0 °C加热到40 °C进行温度扫描,以研究存储和损耗模量行为随温度的变化。进行稳态剪切速率扫描,以测量聚合物网络在0.01至1000 s−1不同剪切速率下的粘度和屈服应力。为了测量自愈能力,进行了阶梯应变测量。对样品施加高应变量(200%)30秒,然后 30 °C 下反复施加低应变量(1%)相同的时间。通过添加 a-CD 添加剂后粘度下降来评估清洗剂的去除能力,随后进行稳定的剪切速率扫描,扫描范围0.1至1000 s−1。
三、结果
3.1 全向打印嵌入式网络(OPEN)的设计和制造
现有的支持介质有两种类型:颗粒状凝胶介质或散装凝胶介质。前者的典型例子是明胶颗粒或Carbopol,它们受到制造复杂性、工作温度窗口和离子敏感性的限制。散装凝胶培养基虽然易于制备,但由于难以调节培养基的粘度而难以去除,而这是从构建体中成功去除支持介质所必需的。为了将散装凝胶培养基的易打印性和颗粒状凝胶培养基的易去除性相结合,设计了一种基于疏水相互作用的支持培养基。这种OPEN 是通过在一步混合过程中将两种FDA批准的市售材料组合而成的。使用的材料是H-HPMC和PF127(图2A-i)。单独的Pluronic二嵌段共聚物不能作为自由形式书写的支撑材料,因为 PF127胶束纠缠网络是一种不可恢复的水凝胶,在喷嘴移动后会导致裂缝形成。此外,由于 PF127在非缠结胶束或单聚体状态下以液体为主的特性,打印到PF127悬浮液中的结构会下垂。为了克服单独使用PF127的局限性,假设PF127非缠结胶束悬浮液可以与疏水性聚合物一起形成一个支撑和可恢复的网络,用于通过物理交联进行全向3D打印。为了验证这一假设,选择了具有生物相容性H-HPMC,因为在低H-HPMC浓度下,高密度的疏水部分促进了PF127胶束的疏水核心与H-HPMC羟丙基末端的疏水硬脂基之间的物理相互作用(图2A-ii)。在优化了H-HPMC和PF127的成分比例后,确定了a-CD(也获得了FDA批准)可作为一种有效的去除剂。a-CD应用于OPEN聚合物网络,通过a-CD(主体)的疏水内腔和H-HPMC(客体)的疏水硬脂酰基之间的客体-宿主相互作用,迅速降低网络粘度。单独的a-CD结构类似于一个空心锥体,内部疏水,外部亲水。当H-HPMC存在时,大多数侧链被a-CD的疏水内表面包裹,形成轮烷络合物。这种复合物破坏了H-HPMC侧链之间的疏水相互作用,从而破坏了整个OPEN凝胶,导致OPEN的粘度降低(图2A-iii)。
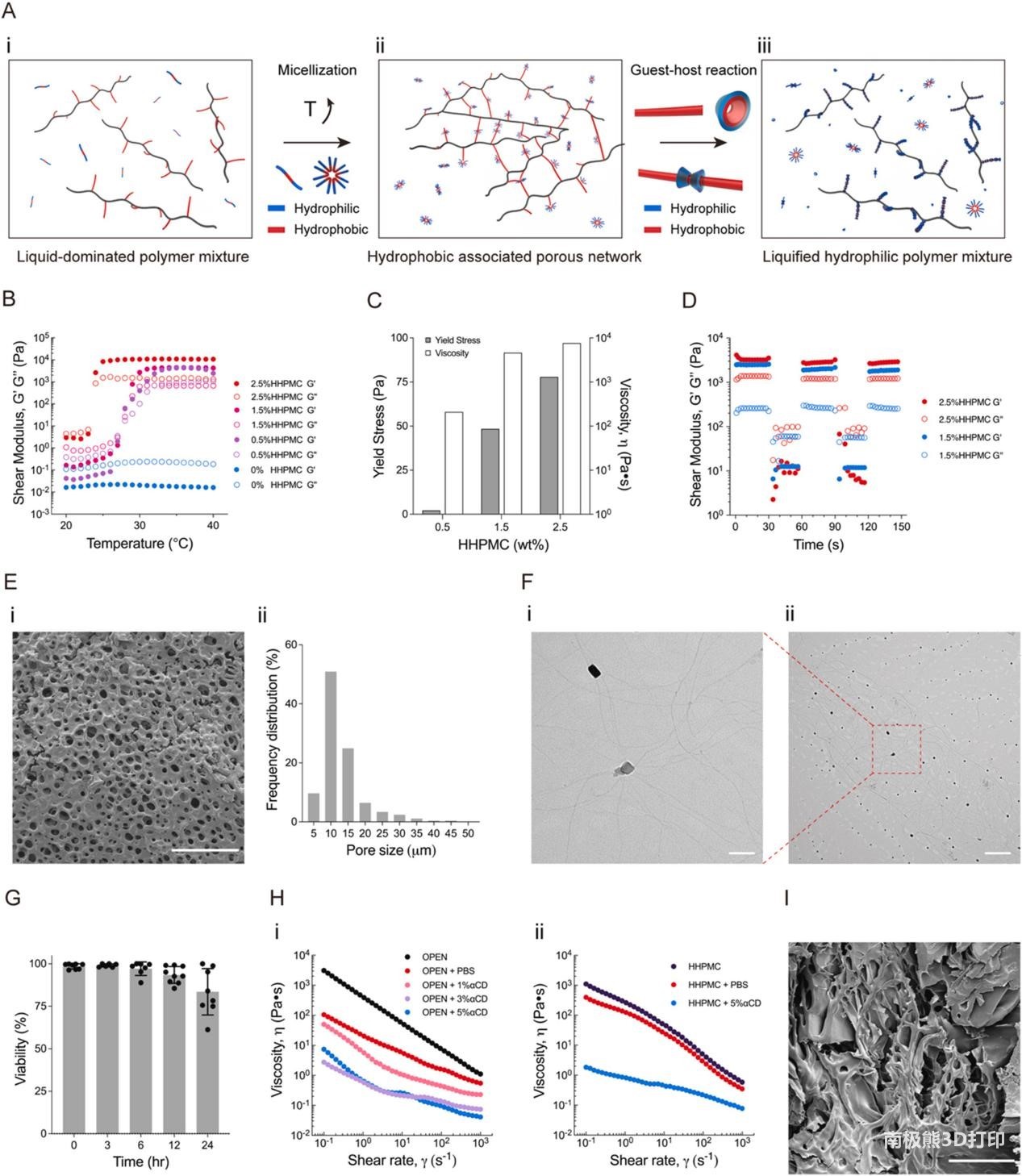
图 2. 通过流变学、形态学和相容性评估对OPEN形成和液化进行系统表征。(A) OPEN形成和稀疏机制示意图。(i) 单体PF127和H-HPMC在低于临界胶束化温度的温度下均匀混合形成液相混合物。(ii)混合物被加热以形成用于包埋印刷的疏水伴生网络。(iii)打印后,利用α-CD改变网络的疏水性,导致聚合物网络液化。(B)含有12.5 % PF127和不同浓度H-HPMC的混合物的温度扫描,表明H-HPMC给出的温度依赖性溶胶-凝胶转变。(C)通过添加1.5或2.5 % H-HPMC来实现打印所需的屈服应力(<100 Pa)。(D)阶跃应变测量证明了聚合物网络的自修复特性。(E) OPEN的SEM图像显示其多孔网络结构,平均孔径小于20 μm。比例尺,100 μm。(F) OPEN的TEM图像显示H-HPMC微原纤维与随机分布的PF127胶束相关。比例尺,(i) 100 nm和(ii) 500 nm。(G)通过在24小时内细胞-材料直接接触的活力测定来评估OPEN的生物相容性。对于生物重复,在6 h n ≥ 6小时内观察到高细胞存活率。(H) (i) 通过添加3-5 wt% α-CD可以显著降低 OPEN粘度。(ii) 5 wt% 的α-CD同样降低了H-HPMC的粘度,证实H-HPMC在拟议的客体-宿主反应中起着至关重要的作用。(I)液化OPEN的SEM 图像,显示多孔聚合物网络的破裂结构。比例尺,100 μm。
通过调整Pluronic和H-HPMC的重量百分比优化OPEN的流变特性,以最大限度地提高其支撑能力。考虑到H-HPMC本身的溶解度极限约为3 wt%,对OPEN凝胶进行温度扫描,从15 wt% Pluronic开始,这是失去非缠结胶束结构之前的最大浓度,以及2.5 wt% H-HPMC。基于12.5 wt% Pluronic的OPEN 凝胶在从室温到体温的所需温度窗口内表现出稳定的固体特性和可调模量,适用于生物打印(图2B)。其他组合物,如5 wt%和10 wt% Pluronic,显示出以流体为主的特性,而15 wt% Pluronic 表现出低模量可调性。接下来,通过测量凝胶屈服应力和可恢复性来表征基于12.5 wt% Pluronic的OPEN凝胶中的网络形成。随着 H-HPMC 浓度的增加(即更多的疏水部分),观察到更高的屈服应力和粘度,证实了网络内更强的疏水结合。1.5 wt%和2.5 wt% H-HPMC 凝胶在100 Pa下均显示出屈服应力值(图2C)。为了研究OPEN凝胶的自愈性,应用高应变幅度(200%)来破坏网络形成,然后立即恢复1%的应变(图2D)。这两种凝胶浓度在几秒钟内表现出相似的自恢复特性。然而,具有较高H-HPMC比率的网络在破坏和重组循环中表现出更好的储能模量恢复。因此,根据其打印温度窗口、支撑能力和自我恢复能力,确定12.5 wt% Pluronic 加2.5 wt% H-HPMC是OPEN制备的最佳组合物。有着支撑稳定性、印刷精度和与各种交联策略的兼容性。
在本文中,旨在探索凝胶网络的内部形态,以阐述其支持机制。为了探索与网络形成相关的疏水相互作用,检查了OPEN的微观结构。SEM图像显示,OPEN凝胶自组装成平均直径小于20 μm的孔几乎均匀分布的结构(图2E )。然而,用低浓度Pluronic或H-HPMC制备的OPEN 凝胶无法组装多孔网络并表现出无定形形态。在12 wt% 基于Pluronic的 OPEN中,将H-HPMC的浓度略微降低至1.5 wt%,将产生孔径的异质分布,与最佳 OPEN 组成相比,这导致较低的屈服应力和恢复能力。ESEM 还证实,在其水合状态下的大多数网络孔径小于20 m。H-HPMC纤维的高度互连性质也得到了可视化。为了了解OPEN的形成和自愈机制,还通过TEM研究了H-HPMC纤维的多级分子结构。H-HPMC微原纤维在纳米尺度上表现出柔韧和高纵横比的细丝。PF127胶束的微观结构在文献中已经得到了很好的研究,它们是直径约为20 nm的高度均匀的球体。作为PF127球形胶束和H-HPMC原纤维聚合物的水凝胶混合物,假设PF127胶束的疏水片段与H-HPMC微原纤维的疏水侧链之间的非共价相互作用调节了自组装和剪切稀化性能。胶束和原纤维之间的典型相互作用在 TEM图像中显示,H-HPMC微原纤维组装在随机分布的PF127胶束上(图2F)。在打印过程中,由于喷嘴引起的剪切应力超过了OPEN的屈服应力,因此喷嘴切断了多孔OPEN凝胶。同时,生物墨水沉积在裂缝中。由于PF127胶束与H-HPMC的硬脂基之间的瞬态和可逆相互作用,剪切应力去除后发生了快速的自愈过程。此外,由于OPEN专为生物打印而设计,通过细胞接种评估了OPEN的生物相容性。细胞保持活力(>97%)至少6小时,这比打印过程要长(图2G )。
此外,3-5 wt% a-CD添加剂的有效减薄行为(图 2H 和 i),表明一旦打印完成,OPEN就很容易去除。溶剂的过度稀释通常用作其他支持介质的常见去除方法,但不能有效降低OPEN的粘度。当存在a-CD时,OPEN构建体的粘度急剧下降,而不是添加更多溶剂时,这表明OPEN去除是特异性的、可控的,并且只能通过H-HPMC和a-CD之间的疏水反转发生(图2H 和ii)。验证了a-CD破坏多孔OPEN凝胶的能力,从而通过对洗涤后分解的网络和剩余的部分孔结构进行成像来导致OPEN变薄(图 2I)。
3.2. HEAL 的设计和打印
要使用OPEN建立器官或组织打印的通用打印方案,必须首先确定兼容的生物墨水。GelMA是一种广泛采用的可光交联胶原蛋白样细胞外基质蛋白,常用于生物打印。光交联生物墨水特别有用,因为它不需要特定的交联条件,也不需要生物墨水中存在额外的交联剂。使用GelMA和OPEN,我们确定了打印具有静脉结构的功能器官的最佳方法。由于需要肝移植替代方案,针对3D打印的HEAL进行了优化。使用GelMA/OPEN具有额外肝脏结构的肝脏生物打印也被认为极大地促进了生物工程移植的潜在应用。为了设计导致肝脏结构的打印路径,采用了Couinaud的人类肝脏节段解剖结构作为肝静脉设计的指导,包括肝静脉和主门静脉。由于在没有灌注脉管系统的情况下体积限制和传质受限,在传统打印中,厚组织或器官重建具有挑战性。为了利用嵌入式打印提供的设计自由度,为肝脏分配了一个晶格打印通路,为脉管系统分配了一个循环打印通路。空间位格设计通过为每个单层交替沉积水平和垂直细丝来优化氧气和营养物质的运输。空间晶格设计还确保了打印件内的等效细丝到细丝距离,由于重力限制,这在传统打印中是不可能的。还可以控制打印参数,例如网格布局、网格密度和股线宽度,以为每个组织定制最终结构。结合载有内皮细胞的肾小管静脉构建体,打印了一个带有主要静脉系统的人工肝脏模型,用于进一步的生物医学评估。
3.3. HEAL 构建体中小鼠肝细胞的生物相容性和活性
为了促进HEAL构建体内细胞的肝功能,用特定的培养基培养打印的PMH,以便组装成肝球体(图3A)。首先在体外培养HEAL 21天,以研究PMH的活力。在体外观察到10天后的高活力(>90%)和相对较高的活力(>80%) 2天(图3B)。为了确定打印构建体中的细胞活性,使用免疫荧光染色分析了肝球形态和肝标志物蛋白表达。肝原纤维菌在培养10天后表现出较高的ALB和AA 荧光(图3C和D),表明肝功能。封装的PMH在整个HEAL打印中自组织成球状结构,并获得功能性肝细胞的特征多边形形状。肝球体还表达以下肝脏代谢标志物蛋白,无需进一步诱导:GST、MRP2和CYP 酶。
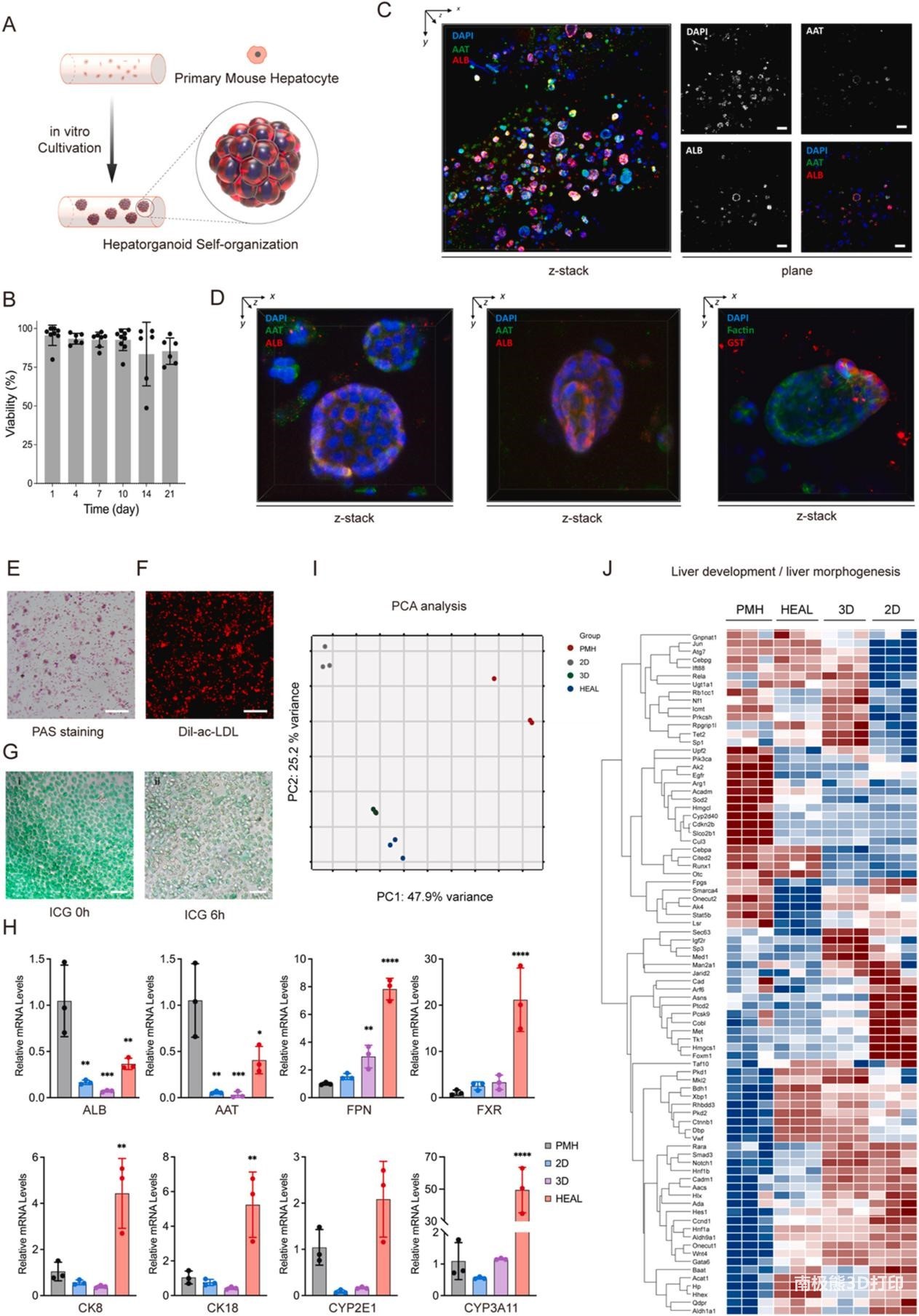
图3. 封装肝球体的体外表征。(A) PMH 在体外自组织成肝球体。(B)打印的PMH的活/死测定表明,在培养21天内具有良好的存活率(>80%)。n≥6用于生物学重复。(C)成熟肝球体的共聚焦(z堆栈,左)和平面(右)图像。比例尺= 100 μm。(D) GelMA生物墨水中肝球体的共聚焦z堆栈图像。左和中:AAT(绿色)、ALB(红色)和DAPI(蓝色)。右:GST(红色)、F-肌动蛋白(绿色)和DAPI(蓝色)。比例尺= 20 μm。(E) PAS 染色显示的糖原储存。比例尺,200 μm。(F)通过Dil-ac-LDL 荧光染色测定的低密度脂蛋白摄取。比例尺,100 μm。(G) 6小时内ICG摄取和释放。比例尺= 100 μm。(H) 在10天的培养过程中通过qPCR 分析检测到的肝脏标志基因的表达。数据以SD±平均值表示。使用单因素方差分析确定统计显着性。*P < 0.05,**P < 0.01,***P < 0.01,****P < 0.005,;n = 3个生物学重复。(I) 12个样品的主成分分析。每个点代表一个单独的样本。K-means聚类由点的颜色(k = 4)表示。(J) 热图显示了PMH (n = 3)、HEAL (n = 3)、2D (n = 3) 和 3D (n = 3)中肝脏发育/肝脏形态发生相关基因表达的分层聚类。
在功能上,肝球体表现出成熟肝细胞的标志性能力。细胞将Dil-ac-LDL导入细胞质中,并通过PAS染色呈阳性,证明糖原储存能力(图3E和F)。此外,ICG摄取和释放试验揭示了细胞的功能状态(图 3G)。此外,10 日龄HEAL中存在中间层,表明移植前有功能性蛋白质分泌。为了进一步支持 HEAL 中的肝球表现出肝功能的观点,除了分析形态和功能活性外,还使用qRT-PCR访问了基本的肝脏特异性基因表达。假设HEAL中的PMH受益于空间晶格设计,因为由于确保均匀的丝到丝距离,氧气和营养物质可以自由扩散到整个结构中。为此,分析了两组PMHs:(1) 2D培养中的PMHs和(2)在散装或HEAL基质中3D培养的PMHs。利用新鲜分离的PMHs的基因表达模式作为功能性肝细胞基因表达的对照组。对于在HEAL中培养10天的细胞,必需肝细胞特异性基因(如Alb和Aat)的表达水平是新鲜分离的PMHs的40 %。其他肝脏标志物基因,包括铁转运蛋白(Fpn)、细胞角蛋白8 (Krt8)和细胞角蛋白18 (Krt18),在HEAL构建体中的表达水平显著高于2D、大量3D甚至PMHs对照组。细胞色素P450、家族2、亚家族e、多肽1(Cyp2e1)和细胞色素P450、家族3、亚家族a、多肽11 (Cyp3a11,人CYP3A4等效物)表达也观察到类似的结果,表明细胞色素P450代谢在HEAL构建体中。总的来说,这些结果表明,与2D和3D大量培养条件相比,HEAL中的肝球表现出更好的肝功能(图3H)。为了系统评估HEAL中肝球体的基因表达谱,并询问HEAL与2D、3D培养物之间的差异,进行了大量mRNA测序。图3J显示了83个肝功能相关基因 (肝脏发育/GO:0001889 和肝脏形态发生/GO:0072576)的热图。HEAL的肝脏基因表达模式与新鲜分离的PMH 非常相似(图3I和J)。值得注意的是,关键肝细胞转录因子(如Jun、Cebpa、Cited2、Runx1和Otc)在新鲜分离的PMHs和HEAL中均高表达,但在2D或3D培养的PMHs中则不高。此外,对PMHs、HEAL和2D组进行了差异基因分析,并从分析中生成了6个具有相似表达模式的簇。有趣的是,DEGs的蛋白质-蛋白质相互作用(PPI)分析揭示了多个肝脏和核糖体基因,这些基因在2D中下调,但在HEAL条件下恢复到正常水平。总之,这些发现表明,转化控制和非酒精性脂肪肝病 (NAFLD) 相关途径可能允许HEAL中的肝球维持肝功能。
3.4. 体内HEAL构建体的新生血管化
由于通过HEAL构建体的体外微型肝脏重建表现出肝脏结构和功能,接下来评估了体内构建体的性能,以更好地了解其肝移植的潜力。将HEAL在体外培养2周,移植到小鼠体内,并在体内再放置2周(图4A)。内源性新生血管形成对于体内肝细胞球体的维持至关重要,因为脉管系统是氧气和营养物质输送所必需的,因此细胞功能和存活也是必要的。假设,与传统打印相比,晶格设计中层和链之间保留的间隙可能有助于体内血管生成。然而,单独HEAL中的血管生成与传统3D打印肝脏构建体中的血管生成没有显着差异。为了解决这个问题,修改了HEAL打印设计,包括肝静脉和门静脉,并将C166细胞作为细胞构建块掺入静脉打印中(图4B)。将血管内皮生长因子(VEGF)应用于载有C166的生物墨水上,以促进内皮细胞增殖。
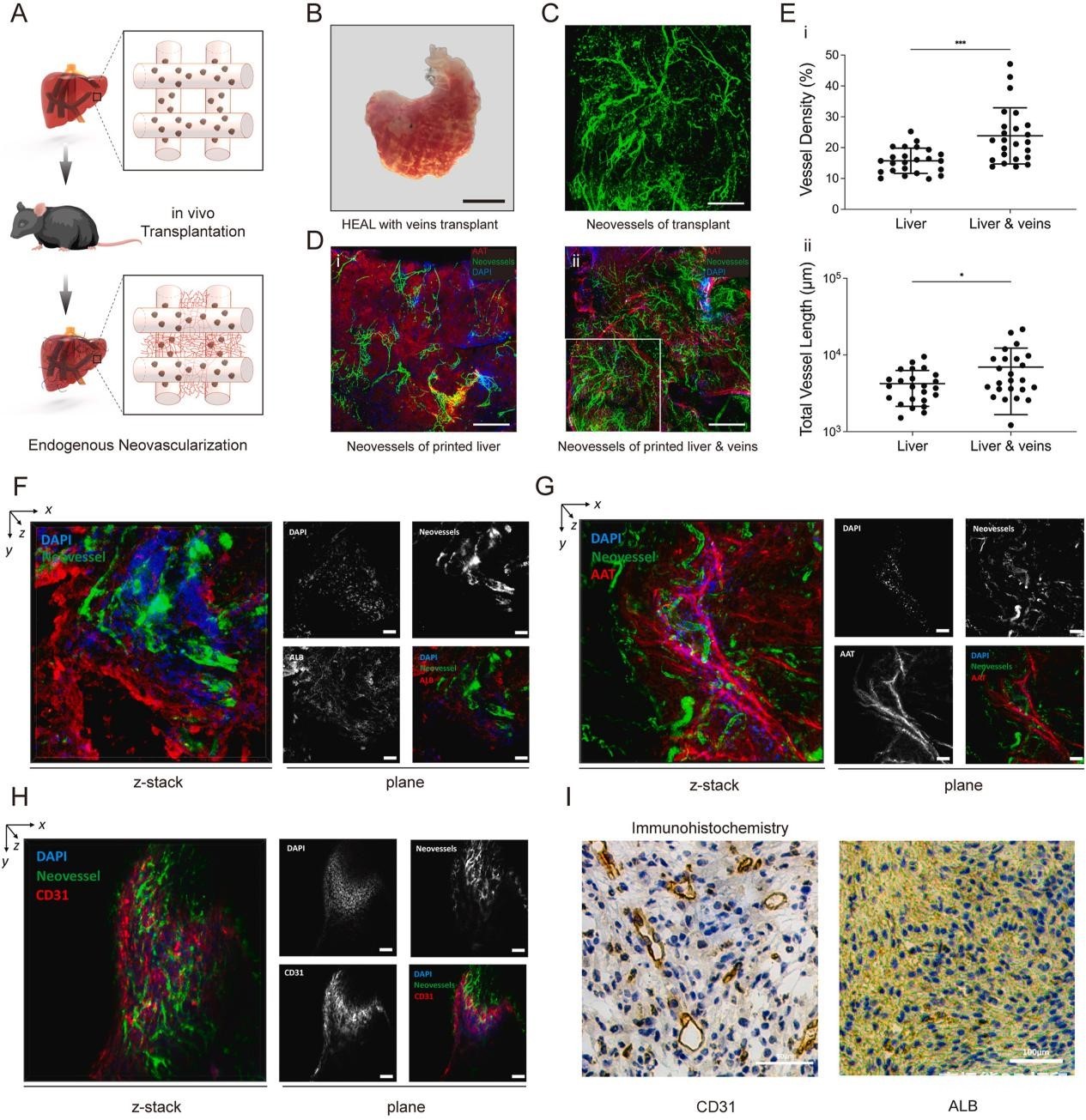
图4. 有或没有静脉结构的HEAL移植的体内新生血管形成。(A)通过载有肝球链之间的保留间隙的内源性新生血管形成示意图。(B)移植14天后血管化HEAL的明场图像,显示打印的晶格结构自由空间上的血管生成。比例尺,20毫米。(C)通过尾静脉注射输注荧光葡聚糖,显示移植内功能性新血管。比例尺,200 μm。(D) AAT 阳性移植部位上新血管的荧光图像,显示从宿主到打印的HEAL移植物的血管化。(i)无静脉的HEAL新生血管化。(ii) HEAL与静脉的新生血管化。比例尺,500 μm。(E)分别定量有或没有静脉的HEAL 的血管密度和总血管长度。(i)与单独的HEAL打印相比,带有静脉的HEAL的平均血管密度增加了10 %。(ii) 与单独使用HEAL打印相比,带有静脉的HEAL的总血管长度增加了约1.6倍。数据以SD ±平均值表示。使用未配对的双尾t检验确定统计显着性。*P < 0.05,***P < 0.01;n = 6个生物学重复。(F-G)肝脏标志物(ALB和AAT)阳性移植成分顶部的新血管的共聚焦(z堆栈,左)和平面(右)图像。ALB或AAT(红色)、Neovessels(绿色)和DAPI(蓝色)。比例尺= 200 μm。(H)血管标志物CD31阳性移植成分顶部的新血管的共聚焦(z堆栈,左)和平面(右)图像。CD31(红色)、新血管(绿色)和 DAPI(蓝色)。比例尺= 200 μm。(I) 移植玻片的CD31和ALB免疫组织化学染色,证实移植 HEAL 内维持的肝功能和显着的新生血管形成。
完全实现的HEAL显示平均新血管密度增加10 %,总血管长度增加60 %,表明血管生成增强(图4C、D、4E)。这种改善可能是由于打印的内皮细胞和打印静脉内的VEGF的引入。虽然单独的空间晶格设计不足以增强新生血管形成,但充满内皮细胞的静脉和空间晶格设计的结合可能会协同作用,促进体内血管生成。具有阳性ALB、AAT染色以及荧光标记血管网络的显微镜图像的叠加为功能性肝细胞和新血管共存提供了证据,表明该综合方法有效地支持3D打印HEAL内的肝细胞功能和血管生长(图4F和G)。
值得注意的是,在打印静脉的外表面观察到内源性新生血管形成。同时,打印的静脉显示出包埋细胞的衬里,表明包埋的内皮细胞已经形成了汇合层(图4H)。这一观察结果表明,鉴于打印的静脉位于 HEAL 构建体的中心,新血管广泛渗透到移植的HEAL印记的内部。由于打印的载有内皮细胞的静脉在移植后充当血管生成的病灶,因此新血管能够逐渐浸润移植的HEAL内部,从而增强对植入组织的营养和氧气输送。这种整合过程最终支持了植入物的功能和存活,这是成功移植生物工程组织和器官的关键方面。此外,空间晶格设计的采用,结合载有内皮细胞的静脉,可能会增强体内血管生成,最终导致HEAL构建体更有效的性能。利用IHC染色来可视化广泛的血管形成,阳性CD31染色在体内显示内源性血管生成(图4I)。此外,IHC染色显示HEEL在移植2周后保持了极好的肝功能(图4I)。
四、讨论
3D生物打印是一种有效的方法,可以创建具有仿生微环境的模型,这对药物筛选和组织再生至关重要。在过去的十年中,使用临床前模型对生物打印构建体进行植入和功能评估的研究显著增加。然而,由于制造大型空心管状结构和心脏和肾脏等整个器官的挑战,传统生物打印产品的临床转化受到阻碍。这是因为现有的生物打印机无法复制天然微血管系统,并且由于引力而容易导致较大的结构塌陷。嵌入式生物打印是一种新兴的挑战解决方案,因为这种新颖的凝胶-凝胶-方法使用机械弱或低粘度的生物墨水,通过减轻引力来生产大型和复杂的3D结构。支撑槽的使用有助于打印多种复杂结构,包括骨骼和心脏,并增强形状保真度。
肝脏是与人体至关重要而错综复杂的器官,具有合成和分泌、药物代谢、血液凝固和免疫等多重功能。虽然肝移植是终末期肝病的实用解决方案,但其疗效受到供体稀缺和免疫排斥的限制。肝组织再生工程已成为一种有前途的肝脏供体替代策略。先前的肝脏生物打印研究主要依赖于基于挤压3D生物打印技术,使用明胶或藻酸盐作为生物墨水,并生产出尺寸较小的网格状结构,通常为1cm×1cm,厚度为4层。使用脉管系统实现大型器官水平肝脏生物打印仍然难以捉摸。鉴于这一限制,建议探索使用创新支持培养基OPEN打印具有静脉结构的微型肝脏并评估其肝功能和血管生成潜力的可行性。
首先定制了基于OPEN和GelMA组合的生物制造方案,GelMA是一种一次性形成的细胞外基质(图1B和C)。根据节段性肝脏解剖结构设计打印路径,并使用嵌入GelMA墨水中的活细胞打印这些结构(图1D)。代表性的PMH和C166细胞被用作封装的细胞构建块,在体外重建具有静脉结构的生物功能HEAL(图1E)。在HEAL中,PMH在体外自组织成肝细胞球体,表达多种肝脏标志物,与传统的2D或3D批量培养条件相比,肝功能和肝基因表达得到改善(图3)。然后,将生物活性HEAL移植到小鼠体内,并在体内放置两周(图 2A)。肝球状体包封的移植促进了体内成熟肝球状体的内源性新生血管形成并维持了成熟肝球状体的标志物蛋白表达(图2B-H)。与没有静脉和常规网格打印的 HEAL 相比,带有内皮细胞的静脉的 HEAL 移植促进了体内新生血管形成(图2E)。因此有效地证明,OPEN 作为一种新型支持培养基,能够嵌入具有静脉结构的3D-HEAL生物打印,在体外表现出令人满意的肝功能,在移植后体内表现出血管生成潜力。
尽管在3D 嵌入式生物打印构建肝组织方面取得了研究成果,但仍然敏锐地意识到具有静脉结构的HEAL的结构和功能与真正的肝脏还相去甚远。肝脏的复杂性包括一个高度复杂的解剖框架和多种生理功能,肝小叶是组成部分。这些小叶由门静脉三联征、肝细胞在毛细血管网络和中央静脉之间呈线性线状排列。除了肝细胞外,肝脏还隐藏着一个错综复杂的导管网络,包括Glisson系统、肝静脉系统和胆道系统。因此,虽然复制功能良好的肝球体和静脉结构势在必行,但复制动脉结构和胆管同样重要但具有挑战性。在探索肝细胞和内皮细胞之间的相互作用方面也有局限性,包括体内和体外。没有彻底研究生物材料特性和细胞空间排列的修改如何影响这些相互作用。此外,在细胞水平上,除了肝细胞和内皮细胞之外,胆管细胞、星状细胞和各种免疫细胞(如Kupffer)对于实现肝脏的全部功能是必不可少的。预计多细胞肝脏生物打印将取得进一步进展,从而更好地模拟肝脏微结构和功能。这一目标的实现取决于生物打印技术的进一步改进,包括多喷嘴联动打印,以及能够支持多种细胞类型生长和相互作用的生物墨水和多细胞共培养系统的持续开发。
五、结论
开发了一种称为 OPEN 的大块凝胶支持介质,将该介质与兼容的生物墨水相结合,并创建了 HEAL 结构,该结构可在体外保留肝功能并在体内促进新血管形成。简便的制备、简单的去除方法以及将 OPEN 与不同的生物墨水和交联方法轻松结合的便利性使 OPEN 成为组织或器官 3D 生物打印的有用工具。随着人类细胞重编程和分化的不断进步,平台提供了一种现成的途径来设计具有多种细胞类型的打印结构,以重现具有高度结构和功能相似性的目标组织或器官。设想OPEN将为个性化再生医学铺平道路,有朝一日可以作为器官功能替代手术中使用的可移植替代品。
六、参考文献
Zhuoran Jiang, Bao Jin, Zhu Liang, Yinhan Wang, Shuai Ren, Yongfa Huang, Changcan Li, Hang Sun, Yunzhu Li, Li Liu, Nianlin Li, Jinzhuo Wang, Zhanfeng Cui, Pengyu Huang, Huayu Yang, Yilei Mao, Hua Ye,Liver bioprinting within a novel support medium with functionalized spheroids, hepatic vein structures, and enhanced post-transplantation vascularization,
Biomaterials,Volume 311,2024,122681,ISSN 0142-9612,
https://doi.org/10.1016/j.biomaterials.2024.122681.
(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

