类器官培养,微阵列3D生物打印技术AHM+1!
时间:2023-09-06 10:01 来源:EngineeringForLife 作者:admin 阅读:次
相关研究内容以“A Pillar and Perfusion Plate Platform for Robust Human Organoid Culture and Analysis”为题于2023年8月24日发表在《Advanced Healthcare Materials》。
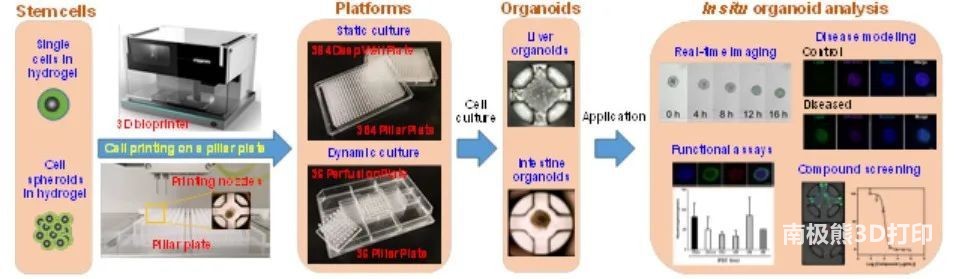
图1 微阵列3D生物打印技术及相关柱及灌注板平台
由于开发的细胞培养系统无法满足需求,本研究开发了微阵列3D生物打印技术和相关的柱/灌注板。微阵列3D生物打印是一种微电磁阀驱动、高精度的机器人细胞打印技术,可以以最小的人工干预快速、重复地创建人体类器官(图1)。

图2 柱板和深孔板的组合用于静态类器官培养
一个384柱板包含384个柱,使用3D生物打印机或多通道移液管分配悬浮在水凝胶中的人诱导多能干细胞(iPSCs)(图2)。柱间距4.5 mm,柱高11.6 mm的384柱板是通过注塑成型制成的(图2A)。孔间距4.5 mm、宽3.5mm、深14.7 mm的384深孔板采用注塑制造(图2B)。
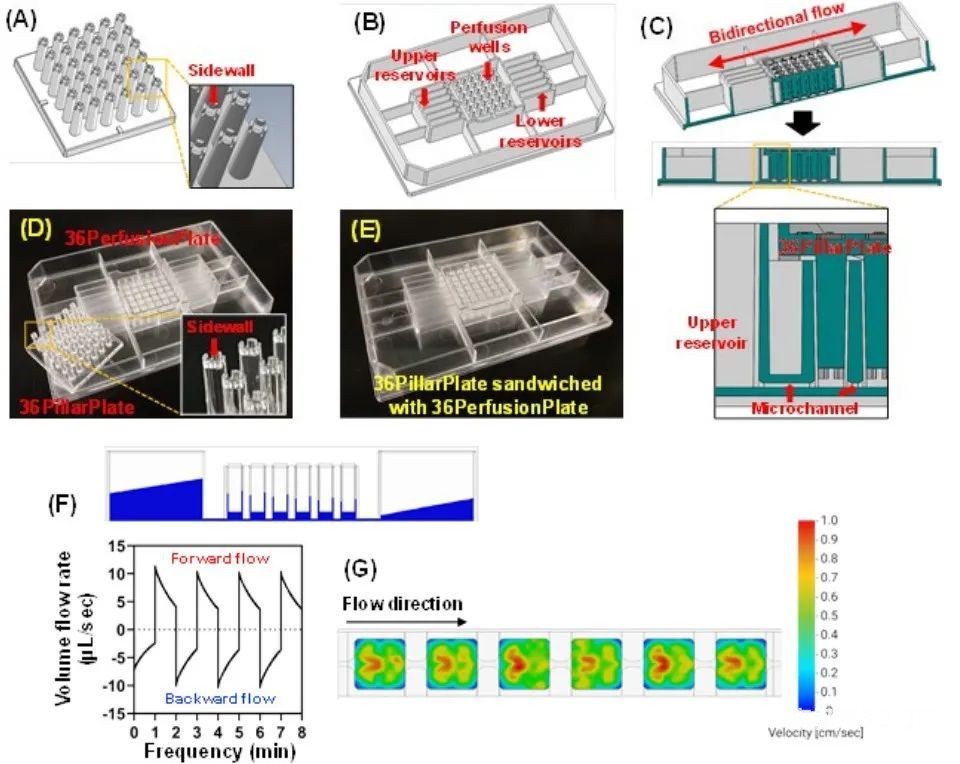
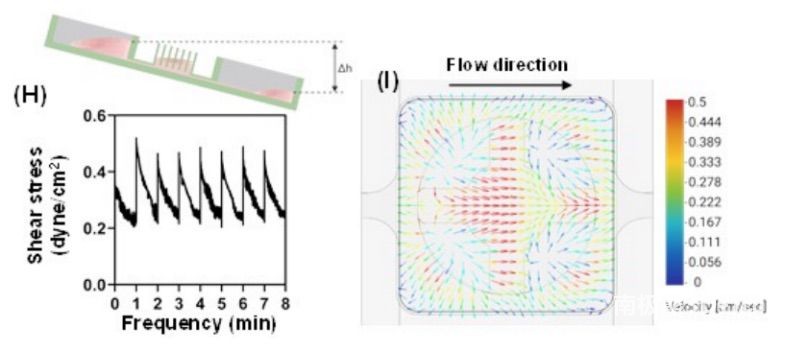
图3 将柱板和灌注孔板相结合进行动态类器官培养
除了384柱板和384深孔板,36柱板和36灌注板都建立在传统的384孔板上,用聚苯乙烯注射成型进行动态类器官培养(图3)。模拟36灌注板中夹有36柱板的灌注孔和储层水位随时间的变化,以避免溢流(图3F)。在灌注孔的柱下发现高速分布,这可能导致柱下的高流体混合,并加速柱上的细胞生长(图3G、I)。
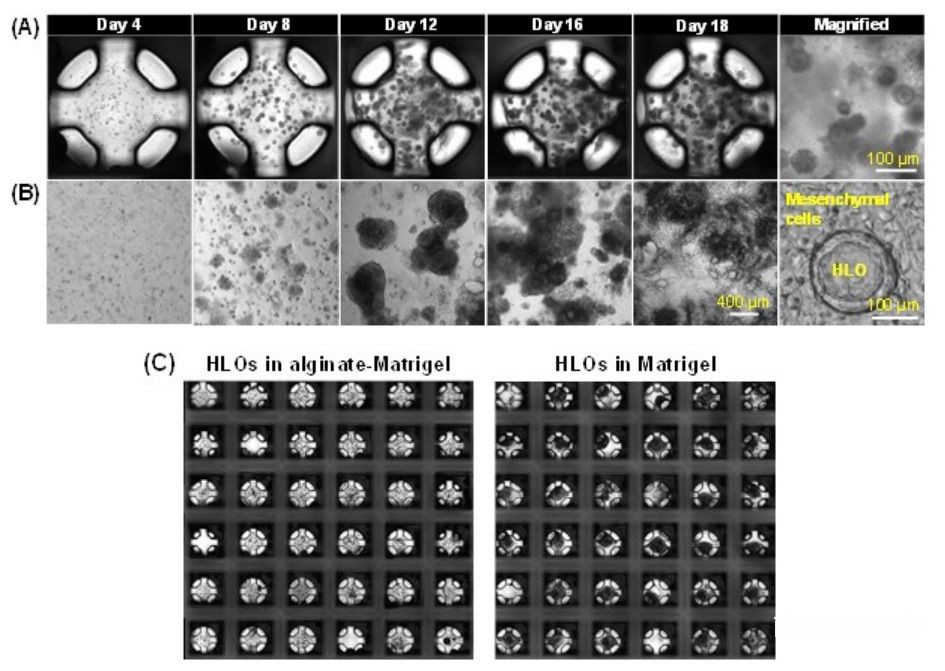
图4 柱板上的生物打印人肝脏类器官(HLOs)
为了成功地将iPSCs分化为类器官并证明其在柱/灌注板中的功能,选择不同分化阶段的iPSCs、仿生水凝胶和含有特定生长因子和添加剂的生长介质是至关重要的。本研究证明了人肝类器官(HLOs)和人肠类器官(HIOs)分别从悬浮在柱板上的海藻酸盐和基质胶混合物中的前肠细胞和柱板上的中后肠细胞球体中的分化。从形态学上看,在柱板和24孔板上培养的HLOs与内腔被间充质细胞包围的圆形上皮细胞层相似(图4A、B)。成熟的HLOs大小为0.1~0.2mm;维甲酸(RA)处理后,维甲酸基质胶(对照)的间充质细胞正常生长,而海藻酸盐和基质胶混合物的间充质细胞生长显著减少(图4C)。
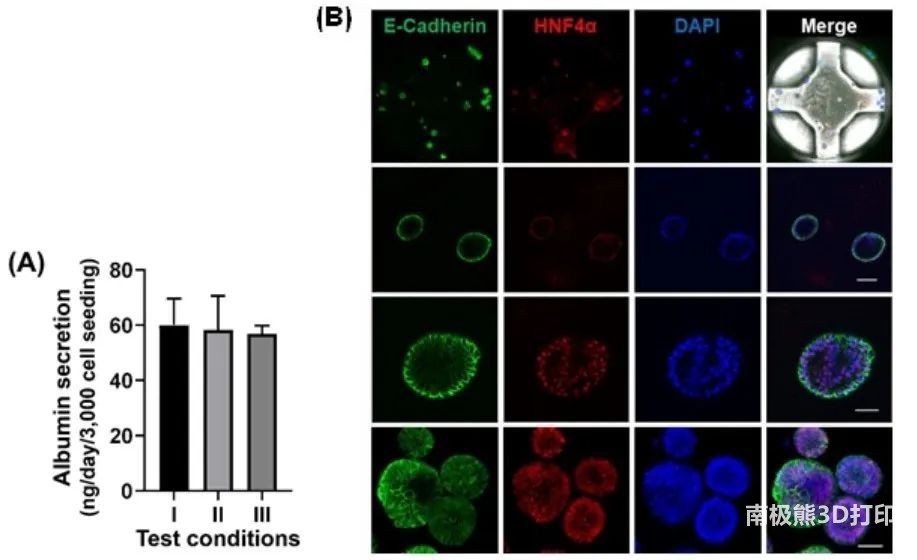
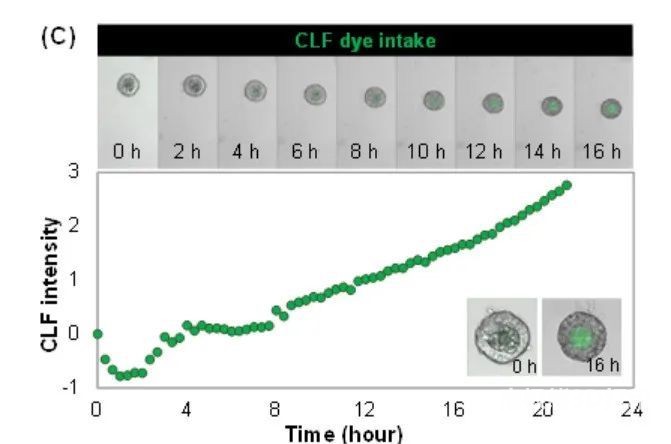
图5 柱板上静态培养的HLOs功能
通过评估类器官形态、白蛋白分泌和肝脏生物标志物的免疫荧光染色比较冷冻前肠细胞在水凝胶打印在24孔板中分化的HLOs。白蛋白分泌数量在三个不同的条件下几乎是相同的(图5A)。在36柱板上生成HLOs后,通过免疫荧光染色检测到HLOs中肝细胞标记物肝细胞核因子-4α(HNF4α)和上皮细胞标记物E-钙粘蛋白的表达(图5B)。在柱板上培养的HLOs(图5B中间)与在24孔板上培养的标准基质板中培养的表达没有差异(图5B为底部)。除了白蛋白的分泌外,通过测量36柱板上的胆汁酸摄入量,证明了HLOs的显微解剖特征(图5C)。

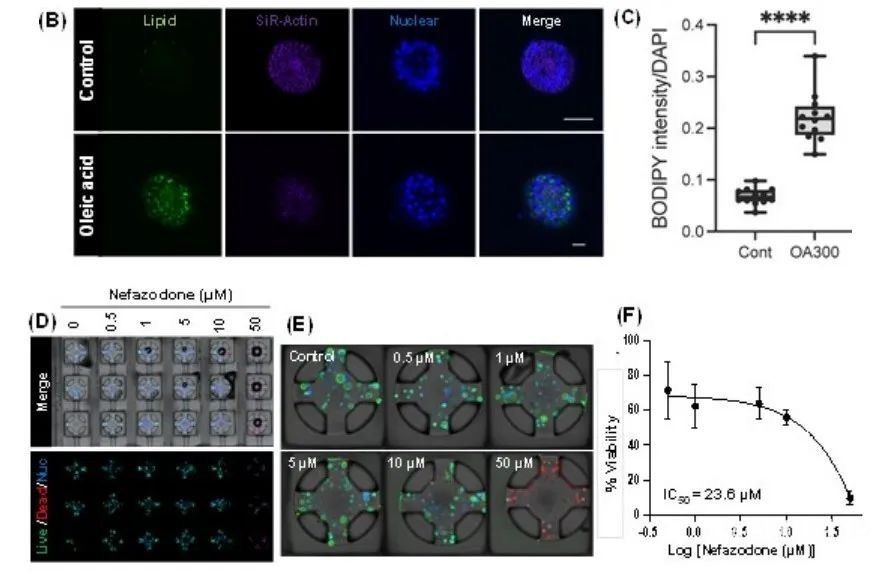
图6 用化合物处理柱板上静态培养的HLOs
通过将HLOs暴露于36灌注板中的脂肪酸72小时,成功地模拟脂肪性肝炎(图6A-C)。通过BODIPY-based脂质染色和图像分析评估HLOs中脂质积累的能力(图6A)。进一步的高倍共聚焦成像显示,经油酸处理后,HLOs的细胞质中积累了脂质滴(图6B、C)。为了评估药物诱导的肝损伤(DILI),将带有HLOs的36柱板夹在含有萘法唑酮的36灌注板上孵育72小时(图6D-F)。药物暴露后,通过将36柱板分离并将其夹在一个含有钙绿素AM和乙型二聚体-1的384深孔板上来测量HLOs活力(图6E),柱子上的绿点和红点分别代表活细胞和死细胞,萘法唑酮浓度的增加导致细胞活力下降。使用细胞滴度-Glo®发光细胞活力检测试剂盒测定萘法唑酮的剂量反应曲线和半抑制浓度值,结果显示细胞活力以萘法唑酮的剂量依赖性方式下降(图6F)。
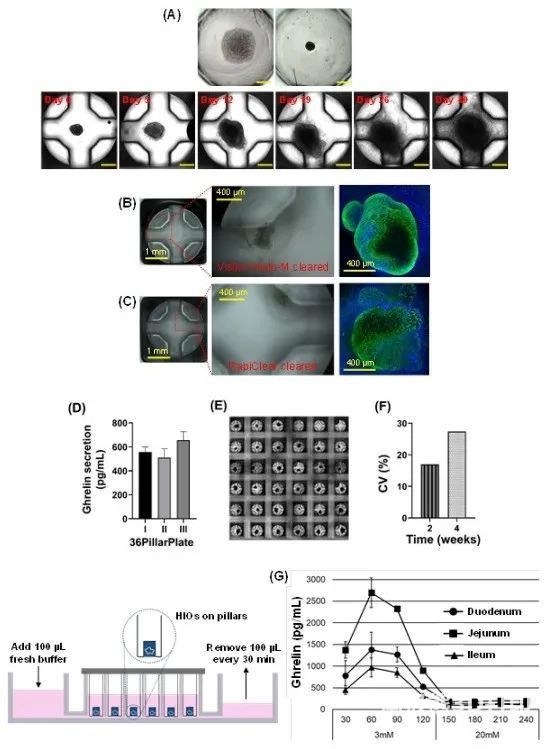
图7 通过将单个中后肠细胞球状体从超低附着体(ULA)384孔板转移到384柱板上,人肠类器官(HIOs)在柱板上均匀分化
中后肠细胞球状体在40天的过程中分化为HIOs(图7A)。HIO在柱板上分化成熟40天后,在柱板上建立类器官原位成像,显示肠上皮发育和细胞-细胞紧密连接形成(图7B、C)。在静态培养中,正常培养基中培养的HIOs分泌非常一致,且具有高度重复性(图7D)。而HIOs在36柱板上培养4周后,柱板上8 ~14 %的HIOs因蛋白酶分泌的基质凝胶降解而分离,5~11 %的中后肠聚集物由于细胞数量少而没有正常分化为HIOs(图7E)。即使当附着在柱板上的HIOs的CV值低于25%时,也能实现均匀生长(图7D、F)。为了研究HIOs是否对像人类肠道一样的营养水平有反应,使用36柱板/36灌注板系统来动态控制柱上葡萄糖水平,从3mM(禁食)到20mM(喂养)(图7G)。这些结果表明,可以通过将球状体转移到柱板上,并通过原位成像或使用简单的流体方式实时监测类器官,从而可扩展地生成均匀类器官。
综上,本研究通过聚苯乙烯注射成型成功制造柱/灌注板,并通过功能分析演示静态和动态的HLO和HIO培养。柱/灌注板通过支持深孔板中生长介质的静态培养或生长介质通过灌注孔板的动态培养维持生物打印单细胞悬浮在海藻酸盐和基质凝胶的混合物中,以及基质凝胶中的细胞球体的长期类器官培养。开发的细胞打印和封装方案具有高度的灵活性,允许在柱板上的基质凝胶中培养多种类器官,从而为化合物潜在的器官特异性毒性提供了更多的见解。本研究在柱/灌注板上展示的微阵列3D生物打印技术代表了一种独特的策略,即快速地在仿生水凝胶中打印PSCs和类器官。柱/灌注板平台上的类器官可以通过模拟体内微环境再现组织发育并维持高组织功能。此外,可以通过高通量、高含量的类器官分析在体外进行复制和阐明化合物的组织功能和机制作用。将生物打印的类器官与高含量的全类器官成像相结合,以更好地了解生成的类器官的功能和化合物的细胞毒性。因此,微阵列生物3D打印技术可以解决类器官研究中未满足的需求,通过结合柱板上PSCs的快速打印,在静态和动态培养中分化和成熟为类器官,模拟人体组织的生理微环境,同时显著提高吞吐量和可操作性,以预测化合物的筛选。本研究设想在柱/灌注板中生物打印的类器官可以为化合物的临床前评估或优先考虑环境毒物提供高度预测的毒性和有效性信息。因此,本研究中独特的方法可以为HTS的类器官检测提供广泛的工业应用。
文章来源:
https://doi.org/10.1002/adhm.202302502
(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

