生物3D打印的胶质母细胞瘤模型模拟细胞外基质力学性能异质性
时间:2023-07-26 10:54 来源:赛箔生物 作者:admin 阅读:次
源于患者的GBM细胞、人类内皮细胞和透明质酸衍生物被用来建立一个人源化的微环境。这项体外研究表明,生物物理信号参与各种肿瘤细胞行为和血管生成潜力,并调控肿瘤细胞转化为不同分子亚型。硬质模型的转录表达与间充质亚型相似,肿瘤细胞呈弥漫性侵袭,并对替莫唑胺展现更高的药物抗性,同时内皮细胞表现出出芽式血管新生形态。软质模型表现出经典亚型相关通路的富集,肿瘤细胞表现出扩张性细胞生长。本研究采用光固化生物3D打印技术,能够实现快速、灵活和可重复的具有生物物理异质性的患者特异性GBM模型,在未来的研究中可以作为一个可调控的系统来研究GBM疾病机制和筛选药物。
3D生物打印的GBM模型具有区域不同的生物物理特性
为了再现空间上不均匀的ECM微环境,并探究ECM异质性如何影响GBM的发展和内皮细胞的生长,作者利用DLP 3D生物打印系统和脑瘤特异性ECM衍生的生物墨水,包括GMHA和GelMA,创建四个不同的模型:纯肿瘤的硬质模型、纯肿瘤的软质模型、共培养的硬质模型和共培养的软质模型(图1A)。共培养模型中采用了人脐带血管内皮细胞(HUVECs)打印内皮区域,以包围肿瘤和ECM区域(图1B)。对ECM区域,作者设计了两种不同的硬度,以模仿GBM组织的硬度和健康大脑的硬度(图1C)。作者进一步使用这些具有不同机械性能的3D打印GBM模型,进行在生物物理信号和培养条件下的评估,包括基因表达、药物反应、肿瘤细胞迁移行为和血管生成活动。(图1E)。
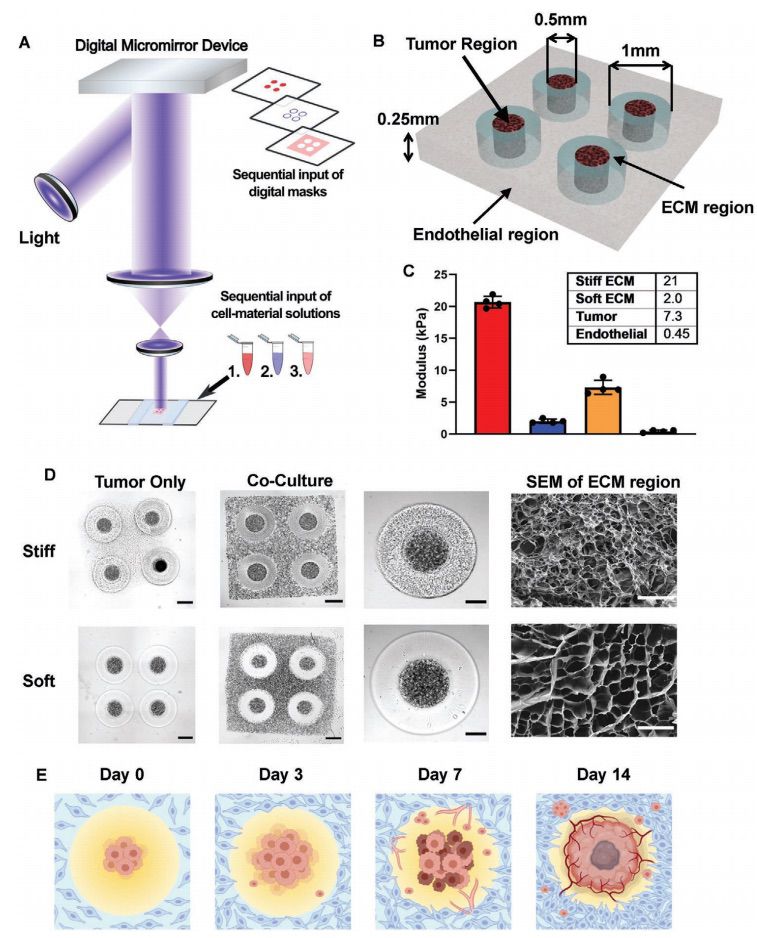
图1. 3D生物打印的GBM模型具有区域性的不同生物物理特性
与球状体培养相比,3D模型具有不同的转录特征
主成分分析显示,球状体培养与任何一种3D培养相比都有截然不同的转录谱,而两种3D培养之间的差异程度较小(图2A)。一些蛋白编码的癌症相关基因或预后基因在两种3D培养条件下都上调了16倍以上(图2B,C)。与球状体相比,与 DNA复制、细胞周期调控和细胞分裂的通路在3D软质模型中明显富集(图2D)。
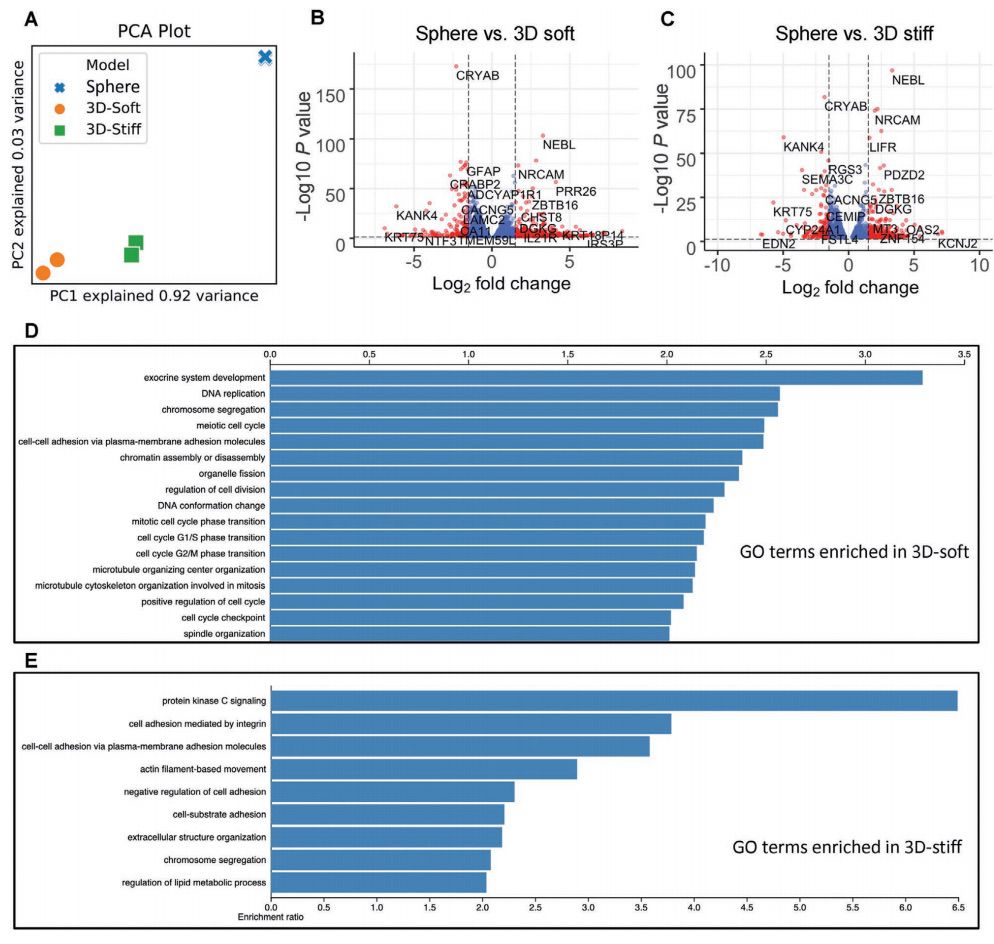
图2. GBM球状体培养和3D模型之间不同的转录谱表达
硬质模型促进了GBM的缺氧和致瘤性特征
与缺氧、癌症侵袭性、E-cadherin缺失引起的转移,以及对干扰素、炎症、ECM和细胞凋亡等外部刺激的反应的相关基因集在硬质模型中明显富集(图3A,B)。低氧相关的基因,以及低氧相关的血管生成标志物VEGFA和SPP1在硬质模型中都被上调(图3C)。免疫荧光(IF)染色显示,软质模型中存在更多的KI67阳性细胞(图3D)。
3D模型诱导不同的GBM侵袭模式和转录亚型
TS576细胞和CW468细胞在软质模型中的侵袭面积分别是硬质模型的7倍和4.4倍(图3F)。与从软质模型中分离出的TS576细胞相比,从硬质模型中分离出的TS576细胞高度富含原发性GBM组织特征(图3G),表明硬质模型将细胞转化为更具有临床意义的状态。
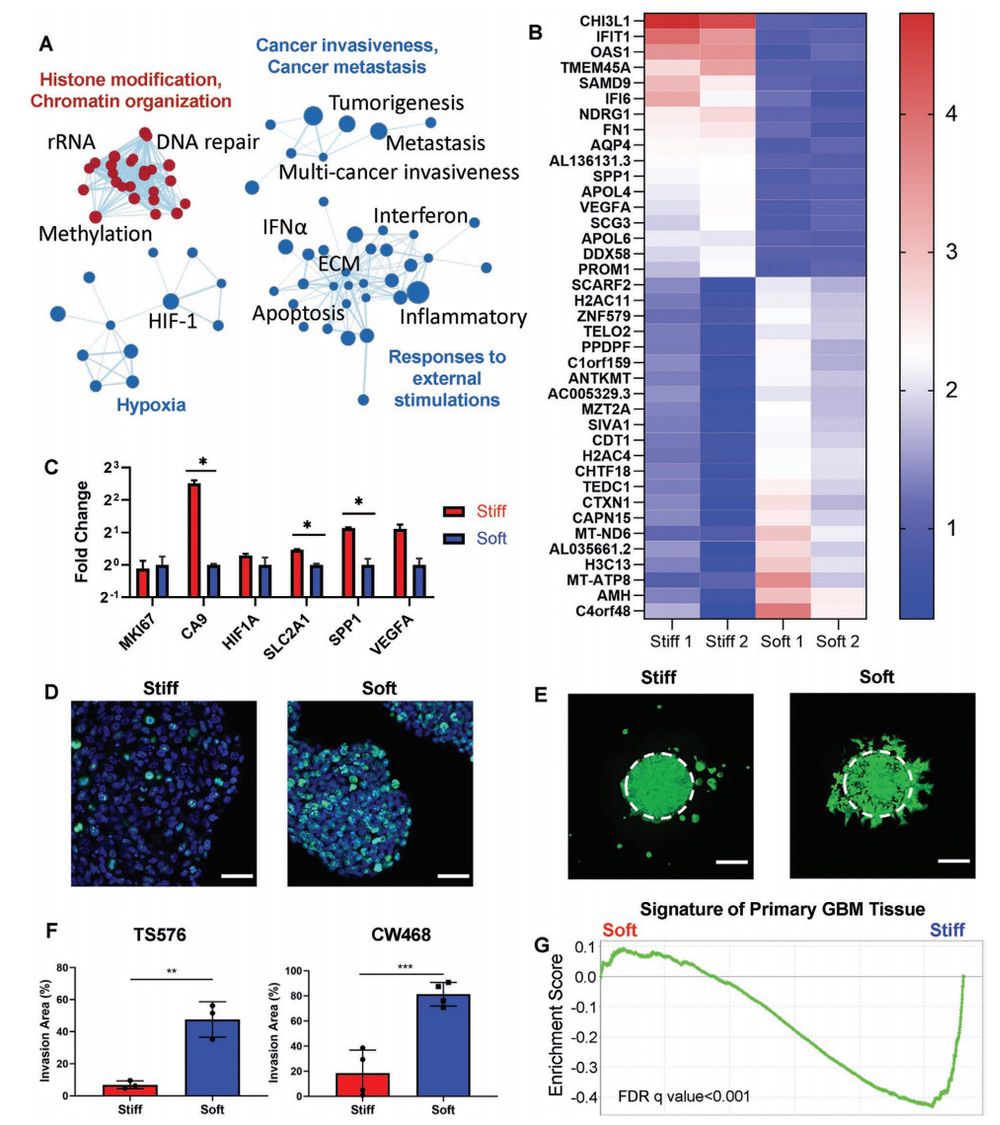
图3. 生物物理模式化诱导了GBM细胞不同的转录图谱和侵袭模式
内皮细胞在3D打印的模型中表现出不同的生长模式和血管生成
在硬质模型中,迁移的CD31+HUVECs表现出类似出芽的血管新生形态,并与SOX2+GBM细胞紧密接触(图4A)。血管生成标志物SPP1和VEGFA在所有的3D模型中都是上调的,并且在硬质模型或共培养模型中明显富集(图4B)。
GBM-内皮细胞交流增强了肿瘤的侵袭和抗药性
肿瘤细胞在软质共培养模型中以类纤维细胞形态扩增,而在硬质模型中则以更圆的形态扩增(图4C)。与球状体培养的细胞相比,所有3D生物打印模型中肿瘤细胞都显示出对TMZ的耐药性增强(图4D)。qPCR分析显示,耐药性相关基因如ABCG2和CXCL12在硬质共培养条件下分别上调了8倍和24倍(图4E),与TMZ治疗反应一致。
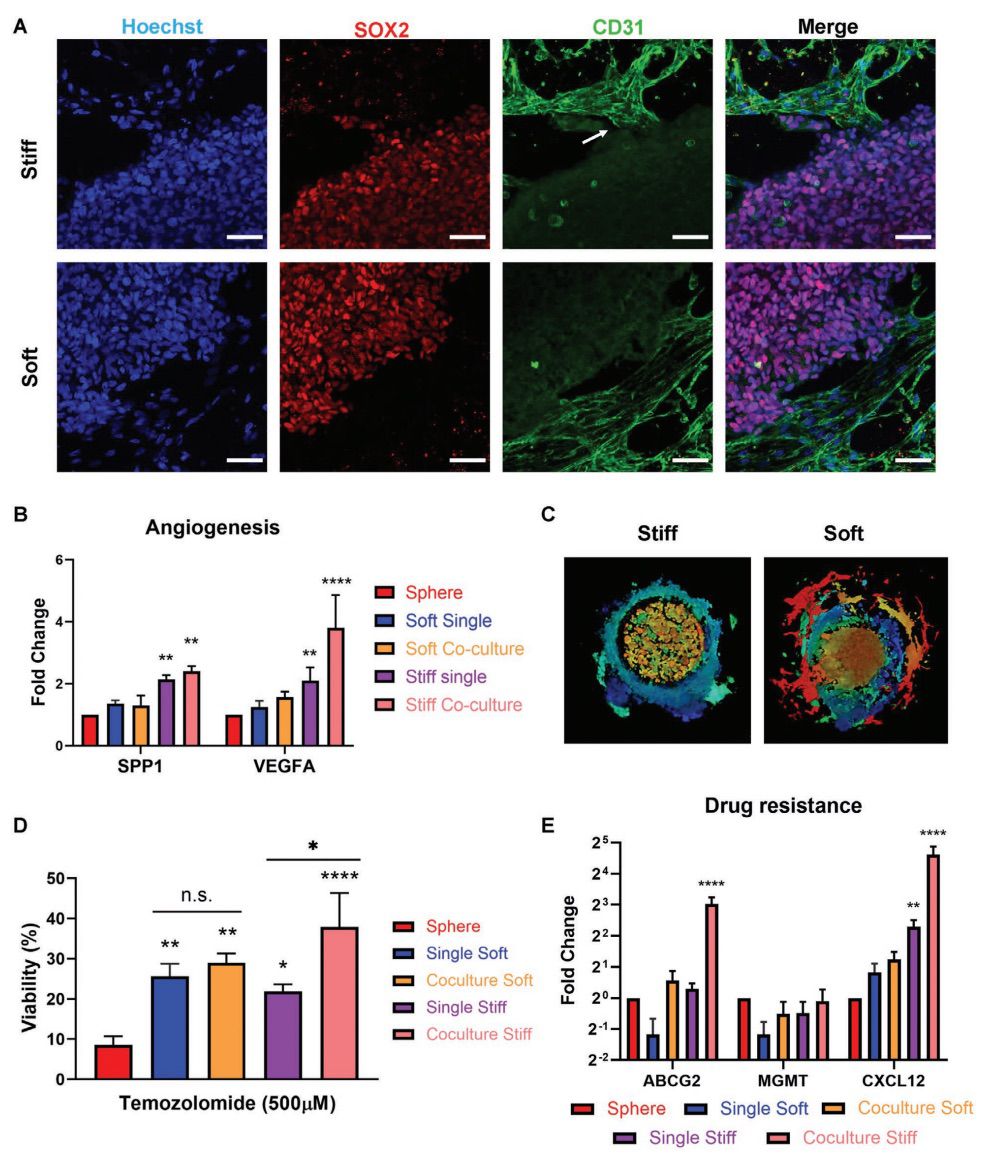
图4. 硬质模型诱导了内皮细胞的萌芽血管生成,增强了GBM细胞的抗药性
结论
本研究中,肿瘤区和内皮区被设计成具有类似于其原始状态的硬度。在肿瘤区和内皮区之间打印了专门设计的ECM区域的两种硬度条件,以模仿GBM重塑的基质或健康的脑实质硬度,并诱导不同的肿瘤细胞生长和行为。细胞在软质模型中迅速增殖和扩增;在硬质模型中,与恶性表型有关的缺氧、干性和血管生成能力得到加强。
肿瘤细胞在两种硬度的微环境中以不同的形态和模式侵入ECM区域。硬质模型中表现出单细胞弥漫性侵袭模式,而软质模型中则表现出扩张性生长模式。这两种侵袭模式都在GBM细胞中被观察到过,这表明硬度变化模型可能适合模拟GBM发展的不同状态。基因集富集分析表明,这两种硬度适合模拟不同的GBM亚型。
血管化是GBM的一个特征,它促进了肿瘤的生长,有利于肿瘤的侵袭。基因表达显示,硬质模型中的肿瘤细胞表达了较高的血管生成标志物,与硬质模型中观察到的出芽表型一致。软质模型促进了细胞的增殖,表现为肿瘤细胞的侵袭面积增大和内皮细胞的增殖。
对所有模型和球体培养对照的TMZ用药处理处理结果显示,硬质共培养模型的肿瘤细胞存活率最高,这表明硬质条件以及与内皮细胞的共培养增强了GBM的抗药性。
本研究中提出的三区硬度模式的GBM模型是第一个将GBM的生理相关的生物物理异质性与生化相关的ECM材料相结合的模型。区域硬度更好地再现了原生环境,并可能有利于更多的生物模拟细胞-ECM和细胞相互作用。未来可用这些模型来研究GBM的不同亚型以及GBM的不同阶段。硬度变化也可应用于未来的模型,研究生物物理对其他肿瘤-基质相互作用的影响。
原文:https://doi.org/10.1002/smll.202006050
(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

