FDA公开征询3D打印医疗设备监管机制反馈
时间:2021-12-17 17:48 来源:南极熊 作者:admin 阅读:次
导读:美国食品和药物管理局(FDA) 正在公开征询面向未来的监管框架评论反馈,确保3D打印医疗设备的质量。
据了解,FDA文件以讨论文件形式发布,不仅概述了护理点3D打印的管理方式,还确定了最终用途的挑战并提供了修订后的潜在规范。FDA表示这些建议不是作为指导,而旨在“提出问题”,因此它现在正在请求医疗3D打印行业的反馈,为未来的监管提供信息。
△在护理点3D打印医疗设备的讨论文件
FDA OSEL和CDRH部门的William Maisel和Ed
Margerrison称,3D打印医疗器械处于创新和医疗保健的前沿。FDA通过讨论文件深入了解3D打印在医院和其他护理点的好处和挑战,并提出了一种潜在的监管方法。文件旨在促进讨论并征求公众反馈意见,为在护理点、患者个性化护理和领域创新方面制定适当的3D打印监管方法奠定基础。
医疗技术行动号召
根据FDA的说法,在医院和手术中使用3D打印可以快速生产患者个性化设备,如解剖模型及其他即时医疗器械。文章还强调了该技术在帮助解决供应链问题方面的作用,例如在新冠疫情的早期阶段出现的全球范围设备短缺情况。
△FDA总部外的标志
目前,此类3D打印医疗设备受到FD&C法案的监管,FDA论文将重点关注那些受到设备和放射健康中心 (CDRH) 管辖的设备。另外,该法案已被用于明晰从Onkos Surgical的3D打印BioGrip植入物到Desktop Metal的Flexcera Base树脂的所有内容,为它们的临床使用铺平了道路。

△3D打印的PhonoGraft仿生植入物。照片来自Wyss研究所
然而,论文也指出了大规模推广此类设备的挑战,包括供应商不太可能拥有与传统制造商相同水平的生产知识。因此,为确保仪器安全,FDA试图寻求反馈定制“监管方法的初步大纲”。
引发医学讨论
在讨论文件中,FDA强调了3D打印机制造商与护理设备生产商在技术和培训之间的差异,导致最终产品质量的不同。这些差异涉及范围从内部流程和临床实践指南等方面到后处理设备的可用性,这在某些情况下对安全至关重要。

△医疗3D打印模型
为了解决潜在缺陷,文章概述了一个五步基础,在此基础上可以建立一种改进方法来调节护理点3D打印设备。FDA打算在该过程中“采用基于风险的方法”,并将一些医疗机构可能会在日常管理时疏忽的风险考虑在内。另外,文章还强调设备制造地点的变化不应影响其遵守规范的能力。当临床医生需要使用任何先进技术时,培训应该就位。有趣的是,FDA也呼吁采用“负担最少的方法”来实现这一目标,并建议“依赖现有标准和流程”。
为了进一步激发关于未来监管的讨论,FDA在论文中提出了三个假设,并鼓励公众对此做出回应:
- 医疗保健机构在现场安装3D打印机
- 医院或手术室也采用相关流程
-
与附近的服务局签约生产医疗设备并交付
在FDA的眼中,每种情况都会引发有关不良反应报告、如何在监管条款中适应设计变更以及哪些设备可以归类为“低风险”的问题。除了这些问题外,文章还提出了额外的讨论要点,包括对未来使用3D打印生产COVID-19设备的反馈。
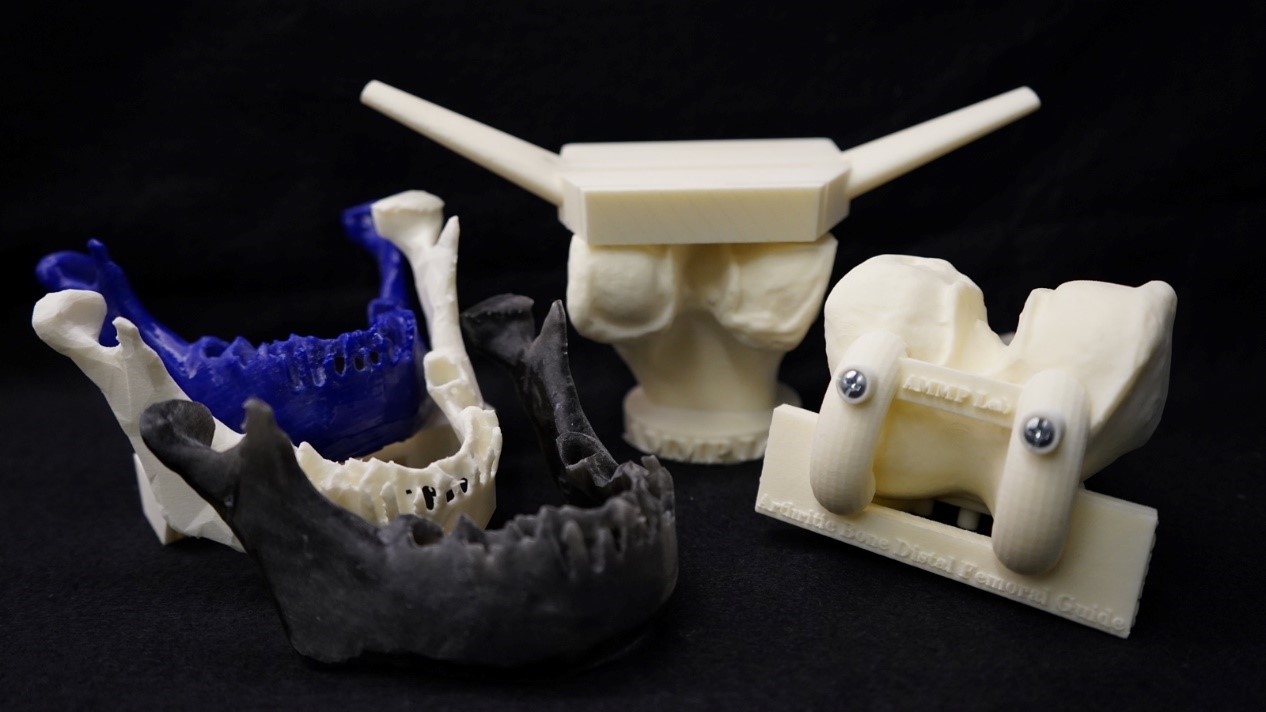
△医疗3D打印模型
最后,FDA表示“所有利益相关者之间的沟通”是“为技术增长和发展创造环境”的关键。3D打印的快速发展使当前的监管机制在未来几年可能会“落伍”,因此需要制定一个修订规范,以“平衡创新与监管监督”。FDA这一计划将持续60天,直到2022年2月8日,虽然尚未提供结果的发布日期,但它表示“预计未来将发布关于该主题的草案和最终指南”。
讨论文件地址:https://www.fda.gov/media/154729/download
感兴趣的小伙伴可以通过以下链接参与反馈:https://www.regulations.gov/docket/FDA-2021-N-1272
参考阅读:
1. Discussion Paper: 3D Printing Medical Devices at thePoint of Care2. 3D Printing Medical Devices at the Point of Care:Discussion Paper
3. FDA ISSUES CALL FOR FEEDBACK ON THE REGULATION OF 3DPRINTED MEDICAL DEVICES
4. ONKOS SURGICAL RECEIVES FDA CLEARANCE FOR NEW 3D PRINTEDBIOGRIP COLLARS
(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

