AFM: 双喷头挤出3D打印复杂孔道GelMA水凝胶用于血管模型和微流体灌注培养
时间:2020-12-03 09:58 来源:南极熊 作者:中国3D打印网 阅读:次
近期,为了克服以上构建三维构建血管网络方法的缺点,以明胶和GelMA作为3D打印的生物墨水,伦敦帝国理工学院生物医学工程研究所Molly M.Stevens团队在Advanced functional materials上发表题为“Void-Free 3D Bioprinting for In Situ Endothelialization and Microfluidic Perfusion”的文章,如图1A图所示,研究者以温敏的明胶基生物墨水作为可打印的牺牲模板,以可光交联的GelMA作为填充细胞外基质模板。37℃下,明胶自发溶解形成贯穿的血管网络框架。
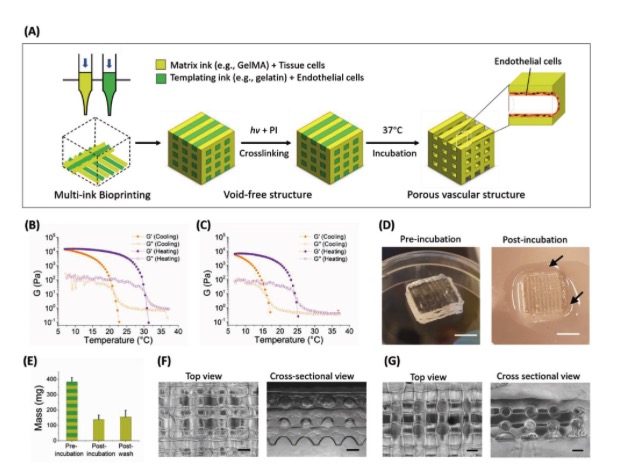
图1 无孔隙构建3D血管网络凝胶支架的示意图及凝胶结构图
以浓度分别为7.5 wt%的明胶和5 wt%
GelMA作为生物墨水,研究者对比了直接3D打印法和无孔隙3D打印法构建带有孔隙结构的GelMA凝胶网络。实现发现无孔隙3D打印法的可打印性更强,凝胶的网络结构更加稳定。且该打印方法也适用于其他生物墨水的3D打印,如双键改性的透明质酸等(图2)。
图2 直接3D打印和无孔隙3D打印的可打印性对比测试图
研究者以人皮肤成纤维细胞(HDF)和人脐静脉血管内皮细胞(HUVECs)为细胞模型,探究凝胶支架中负载细胞的生物活性内皮化进程。研究者将HUVECs预先装载入明胶墨水中,直接打印出无孔结构并进行后续培养,随着明胶的溶解,内皮细胞的黏附和增殖,可获得三维贯通的内皮化结构。原位细胞内皮化实验表明内皮细胞能够均匀分布于孔道内侧,且能够实现良好的增殖活性,形成均匀的连通网络和平行管。经过8天的孵育后,细胞荧光染色中内皮细胞粘附标志物CD31的高表达表明HUVECs增殖形成了一个均匀的细胞单层(图3)。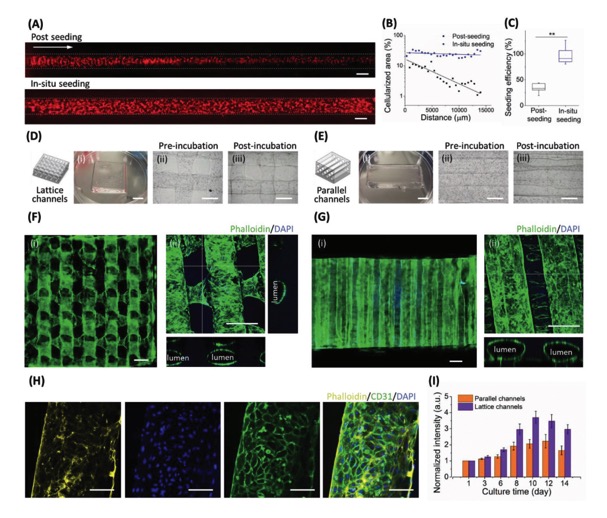
图3 无孔隙3D打印GelMA凝胶支架细胞生物活性及原位细胞内皮化图
除了血管组织工程支架的构建,研究者探究了该无孔隙3D打印方法能否应用于水凝胶基的微流控芯片的构建。如图4所示,研究者用PDMS作为封装和支撑凝胶网络的支架,3D打印构建了不同图案的微流控芯片模型。实验表明,微流体能够均匀流通于凝胶网络中,且不发生扩散。基于该凝胶基微流控芯片的原位内皮化实验表明内皮细胞能够均匀分布于凝胶网络内腔中,并形成贯穿的内皮网络结构。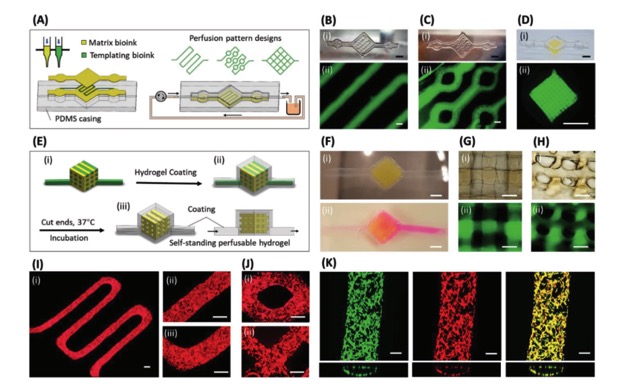
图4 无孔隙3D打印GelMA凝胶用于微流体灌注和原位内皮化细胞芯片实验图
综上所述,研究者通过无孔隙3D打印方法实现了个性化、均一管状结构三维凝胶网络的构建。相比其他牺牲墨水式3D打印方式,该方法解决了三维凝胶网络易坍塌、低粘度生物墨水难以成型、内皮细胞种植效率低等难题,且可以用来构建内部互通良好的水凝胶基微流控芯片。(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

