电纺+近场直写打印小直径血管支架
时间:2020-02-26 09:28 来源:南极熊 作者:中国3D打印网 阅读:次
血管支架有5个要求:
- 支架应提供一种基底,使内皮集落形成细胞(ECFCs)在其上形成单层。
- 支架上形成的内皮细胞单层应表达成熟的EC标志物、基底膜成分和ECM,以及与vSMCs沟通相关的信号。
- 支架应该具有一个多孔的外层,vSMCs可以在其中迁移和填充,以实现多层细胞组织的伸长。
- vSMCs应以近圆周方向排列,具体由可由支架纤维的方向控制。
-
支架应该为间充质干细胞(MSCs)分化为vSMCs收缩表型提供环境

图1 双层管状支架的制造。A)溶液静电纺丝制造管状支架内层。B)熔融电直写将定向纤维沉积在管状支架外层。C)双层支架最终结构。双层支架由同种材料组成,不同尺寸的纤维融合在一起,防止分层。
支架的体外实验结果如图 2,成功将尚未内皮化的ECFCs与MSCs共培养,并且ECFCs未渗透过孔径非常小的溶液纺丝层。扫描电镜(SEM)显示相邻的ECs(黑色箭头)与纤维(白色箭头)之间建立了连接,表明内皮细胞受到限制,通透性较低。在体内,具有屏障功能的内皮细胞是抵抗血栓形成的关键。这样就产生了具有抗凝血特性的内层,类似于天然内皮的特性。
同样,单层膜显示血小板黏附糖蛋白因子(vwF)内皮标记物染色阳性(图2D),并由iv型胶原阳性基质(图2E)支撑,这也天然基底膜中发现,说明了支架仿生性能。一氧化氮被认为是主要的血管扩张剂之一,参与抑制血小板聚集,是功能化内皮细胞所必需的。在实验中中测量到的NO表明,当在仿生双层支架上培养时,所形成的内皮细胞具有功能并具有向类vsm细胞发出信号的能力。
此外,大孔隙和较粗的近场电直写纤维可以诱导类vsm细胞快速渗透,从而满足MSC/ECFC共培养(图2J)和MSC单培养。接种的MSCs覆盖整个支架的外表面(图2G),并呈直线排列(图2H)。IV型胶原也被合成(图2I),它将单个的vSMCs包裹成基底膜样基质。
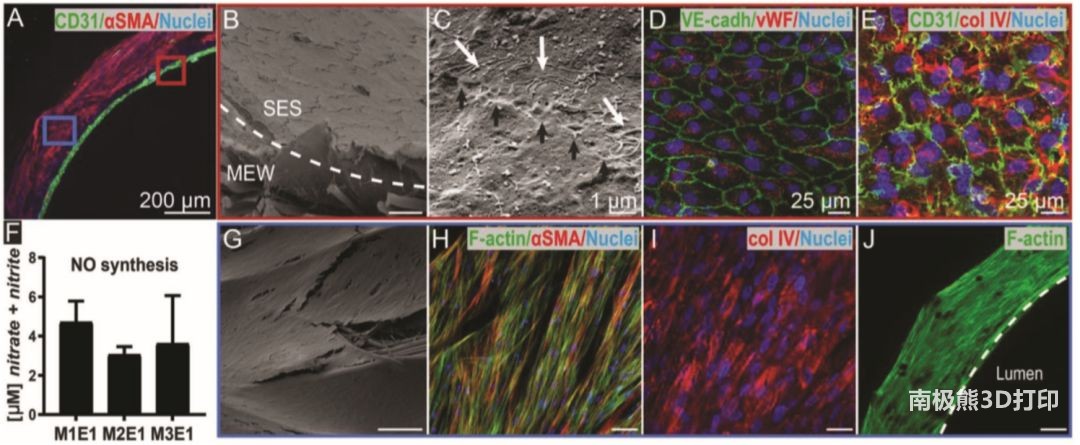
图2 双层异质血管支架上的细胞培养结果。A)的同时培养ECFCs (CD31
+)和vSM-like细胞(αSMA +)后17 天的分层组织
(横断面视图);B)溶液纺丝层上细胞的内皮化;C)紧密的细胞连接(黑色箭头)和细胞挤压(白色箭头);D)和E)内皮细胞的特异性表达;F)内皮细胞产生一氧化氮(NO)向vSM-like细胞传递信号;G)
vSM-like细胞的定向排列;H)沿着纤维伸长的αSMA
+细胞;I)IV型胶原在细胞排列方向的沉积;J)在7天后vSM-like细胞充满了管壁,并呈圆周方向排列。除有特殊标注外,比例尺为100μm。
对于近场电直写的支架外层结构,随着支架纤维缠绕角的增加,细胞的方向改变为近周向(图3A),与原膜介质相同。通过控制纤维的取向,可以模拟组织的方式引导管状支架上的vSMCs的取向。外层的多孔结构促进了细胞的快速生长,并产生了几层定向排列的细胞,细胞间具有密切相互作用。
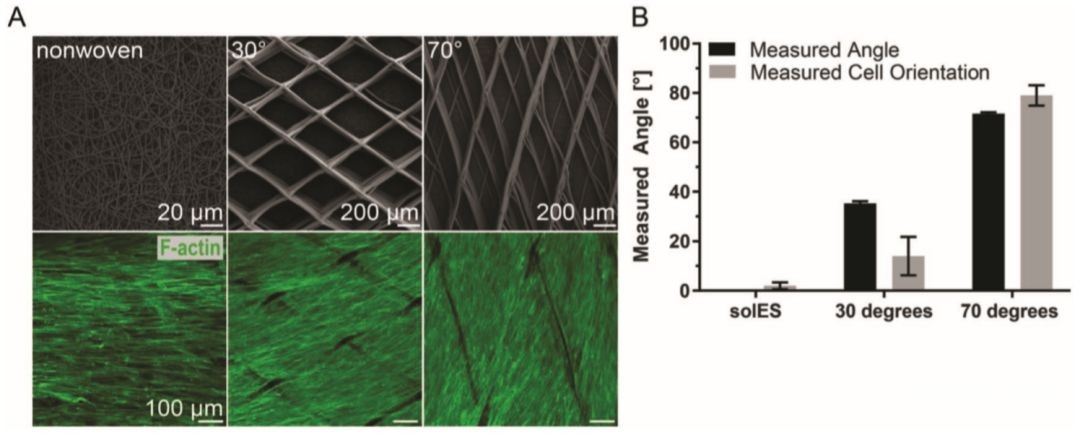
图3 熔融纤维取向对间充质干细胞的影响。A)代表性支架植入前扫描电镜图像(上)和植入后培养7 天后 F-actin染色细胞 (下)。B)整个管壁厚度上的细胞以及熔融电直写粗纤维的平均取向。
为了更深入地调查在大孔径支架上增加的细胞相互间作用对MSCs分化的影响。研究人员比较具备与不具备外侧熔融电直写纤维的细胞结果。结果表明在孔板中与单层溶液纺丝支架上培养的MSCs具有相似的相对基因表达水平。而在双层血管结构培养的MSCs与单溶液纺丝层培养的MSCs基因表达水平具有较大区别。DNA与蛋白表达的实验结果也是类似。

图4 融合驱动的MSCs向vSMCs分化结果。A)培养7 d和14
d后在孔板中与单层溶液纺丝支架上培养的MSCs相似的相对基因表达水平;B)培养7 d和14
d后,双层血管结构培养的MSCs与单SES层培养的MSCs基因表达水平的比较;C-D)qPCR对比结果;E-H)细胞在单纯溶液纺丝支架与双层异质支架上的蛋白表达区别。
这种复合结构的异质支架具有类似于原生血管内外膜结构,内侧溶液纺丝层具有小直径与低细胞通透性,能促进内皮细胞层的形成;而低纤维密度、可控沉积定向的多孔外膜是实现类vsm细胞定向快速定植的基础。不需要可溶性因子和表面功能化,紧靠放生的结构设计,引导指导细胞的形态和分化。未来还可以探索是否可以利用这种异型设计来调节免疫反应,使之朝着再生的方向发展。
论文链接:https://doi.org/10.1002/adfm.201905987
(责任编辑:admin)
最新内容
热点内容


 适配多类别高温聚合物FFF
适配多类别高温聚合物FFF 埃肯与Startuplab合作加速
埃肯与Startuplab合作加速 NAMIC 全球增材制造峰会GA
NAMIC 全球增材制造峰会GA 3iD率先引进全新粘结剂喷
3iD率先引进全新粘结剂喷 Freeform人工智能3D打印工
Freeform人工智能3D打印工 Biomaterials science:牛
Biomaterials science:牛 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi 美军使用金属3D打
美军使用金属3D打

