新型3D打印快速DNA分离微流控磁平台
时间:2024-02-22 09:22 来源:南极熊 作者:admin 阅读:次
生物样品的纯化或分离,特别是作为生物信息存储分子的脱氧核糖核酸(DNA),是许多遗传学研究、法医学、罕见病临床诊断、癌症诊断和/或病毒疾病的关键和起点。到目前为止,许多不同的技术,如粒径排除色谱法、离子交换色谱法、亲和色谱法、碱性萃取法、盐析法、滤纸、硅胶基质(凝胶、树脂或微球)、磁性珠(市面上有填料柱、重力柱、自旋柱、自旋板和磁支架)等,都已被方便地用于分离DNA。

相较于传统的方法,微流体系统提供小型化的实验室规模的应用,允许在几微米甚至纳米的操作,实现更好的准确性,减少分析时间,并提高整个隔离过程的可靠性,同时最大限度地减少交叉污染的风险。在微尺度上精确控制流体的能力为用连续流动过程和微流体系统中的各种功能组件(如通道、阀门、泵、混合器和传感器)取代批顶设备开辟了许多可能性。在这项研究中,我们提出了一种新的磁性平台,作为在螺旋微流控装置中操纵超顺磁珠快速分离DNA的创新解决方案。建立了一个计算模型来评估永磁体在平台上的定位和旋转。
研究内容
将超顺磁性二氧化硅微颗粒(1mg)加载到基于pdm的微流控芯片中(图1D)。将负载颗粒的微流控芯片放置在磁性平台上(图1A)。磁场是由微流控芯片下的磁体旋转产生的。注射器泵以所需的流速(5−20 μL/min)将缓冲液送入微流控装置。每次实验开始时,用含有6 M Gu-HCl的结合介质1 × TE (10 mM Tris, 1 mM EDTA)缓冲液(pH 6.0)以20 μL/min的速度洗涤2 min,制备分离体系。DNA分离主要通过三个步骤进行:(i)吸附,(ii)洗涤和(iii)洗脱。
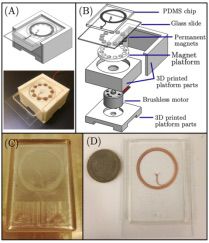
图1 (A) CAD模型及3D打印平台,(B)平台的CAD分解图,(C)用于PDMS成型的金属模具,(D)微流控芯片(硬币直径26.15 mm)。
在15,000、30,000和80,000倍的5、2和1 μm bars的SEM图像中,磁性二氧化硅颗粒在形貌上分别为球形和单分散,约为6 μm(图2B)。表面化学成分包含O、Si和Fe原子,其重量分别为51.03、33.02和15.95%(图2B)。FTIR光谱显示了磁性硅珠的化学结构如图2C所示。1060 cm−1处的峰代表结构中的Si−O−Si键。630,570和440 cm−1处的吸收带属于铁纳米粒子(Fe−O拉伸)。6通过VSM分析获得的磁滞曲线(图2D)来评估颗粒的磁性。磁滞曲线呈现超顺磁特征,磁饱和度约为10 emu/g。此外,氧化铁纳米粒子(SPION)包覆的二氧化硅微粒子对矫顽力没有永久磁化。
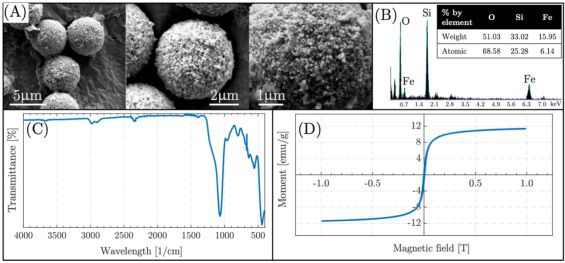
图2 (A)合成磁性颗粒的形态结构(SEM图像),(B)表面化学(EDX结果),(C)化学结构(FTIR光谱),(D)磁性能(VSM结果)。
采用两种不同类型的DNA作为模型DNA:鱼精子DNA和不同浓度的人胎盘DNA进行微流控DNA分离。首先用鱼精子DNA进行分离,每步的流速为10 μL/min。分离在30分钟内完成(吸附10分钟,洗涤8分钟,洗脱10分钟,更换注射器约1分钟)。在pH为6.0的结合缓冲液中,鱼精子DNA被吸附到颗粒上。如图3A所示,鱼精子DNA吸附量随着DNA负载量的增加而增加。在一定数量的DNA后,吸附剂(磁性二氧化硅颗粒)达到饱和点,不再吸附吸附剂分子(DNA),从而达到最大吸附容量(qm)。吸附效率曲线显示,实验qm约为100 μg/mg颗粒(图3A)。Sips吸附模型也被用于理解吸附过程的行为。Sips模型对鱼精子DNA吸附的回归系数(R2)为0.990。模型的qm值为121 μg/mg。吸附等温线模型表明,该体系可能以化学吸附为主,可以认为是一个单层吸附过程。利用人胎盘DNA研究了在相同条件下(每步流速为10 μL/min,结合缓冲液pH为6.0)系统的吸附行为。选择较高的浓度来确定不消耗DNA样品的最大吸附量(图3B)。实验发现qm约为110 μg/mg,这与文献中几种批处理系统中使用的磁性纳米颗粒(16−121 μg/mg)相当。Sips模型拟合实验数据点,回归系数为0.998,qm为109 μg/mg,与实验数据吻合良好。采用不同pH值的1 × TE缓冲液测定其解吸效率。以10 μL/min和100 μL洗脱量的鱼精子DNA在室温下重复实验3次(图3C)。
结果表明,化学相互作用在解吸过程中也起主导作用。随着洗脱缓冲液pH值从7.0增加到9.0,解吸效率也从18%增加到38%。
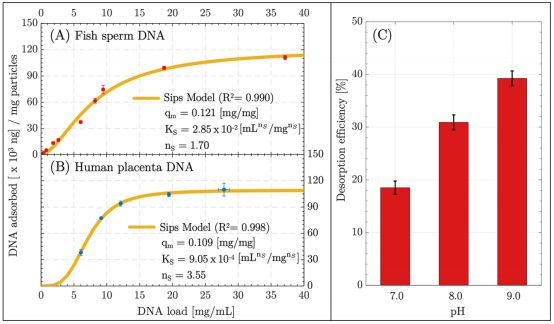
图3 (A)鱼精子DNA和(B)人胎盘DNA的吸附量。在每种流速下(样品流速为10 μL/min),三次独立重复实验的平均值均为±标准误差。(C)不同ph值下鱼精子DNA的解吸效率。每个pH值下3次重复实验(样品流速为10 μL/min)。
以鱼精子DNA为模型DNA,结合缓冲液pH为6.0,洗脱缓冲液pH为8.0,研究了流速对分离步骤的影响,比较了类似材料和分离DNA所用的方法。为此,分别以5、10、20 μL/min的流速进行3次重复实验。由图4可知,吸附效率与流速成反比,在10 μL/min的流速下,吸附性能在70%左右达到饱和。在达到饱和后,磁性颗粒不再具有结合额外DNA的能力,这导致吸附效率达到平台期。随着流速的降低,DNA缓冲液在微通道内的停留时间会增加,从而影响颗粒表面与DNA分子的接触时间,从而影响吸附动力学和静电相互作用,从而提高DNA吸附。此外,微粒上的阻力也减小了,这使得DNA分子更容易附着在微粒上。对解吸性能进行评价时,可以明显看出,解吸效率随着流量的增加而增加,当流量为20 μL/min时,解吸效率可达75%左右。这可以归因于作用在DNA分子上的阻力的增强,这有助于从颗粒表面分离。
在模拟中,重离子垂直入射,MCD-FET和CAVET最敏感的位置都在p基右侧,图9中灰色箭头所示,p基附近存在高电场区。考虑到最坏的情况,重离子会穿透整个装置。图4显示了MCD-FET和CAVET在关断状态(VDS = 100 V, VGS = 0 V)下的IDS随时间的变化。MCD-FET和CAVET的IDS均上升到当前峰值(Ipeak),随后逐渐降低。与CAVET相比,MCD-FET表现出10.11 mA的低峰,降低了64.9%。
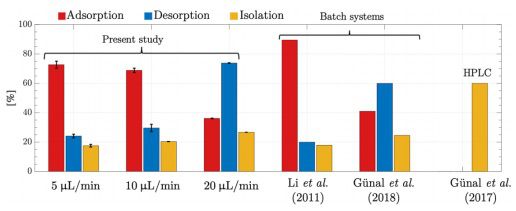
图4 不同流速下平台对鱼类精子DNA的吸附、解吸和分离效率。这些值是在每个流量下三次独立重复实验的平均值,±标准误差。
为了快速分离DNA,总操作时间必须保持在最低限度。吸附效率在5 μL/min时最佳,解吸效率在20 μL/min时最佳。10 μL/min时的吸附效率也接近5 μL/min时的吸附效率。在较短处理时间的最佳操作条件下,吸附步长为10 μL/min,洗涤和解吸步长为20 μL/min,操作时间为10 min(吸附5 min,洗涤2 min,洗脱3 min),分离效率可达50%以上。
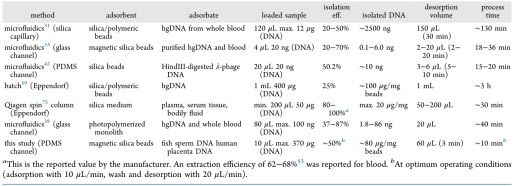
表1给出了我们的平台与文献中可用的其他技术的不同方面的比较。
表1 文献中不同DNA分离方法的比较
总结与展望
在这项研究中,提出了一种新型的小型化装置作为3D打印的微流控磁平台,用于快速分离DNA。这种新颖的设计使磁性颗粒在螺旋微通道的限制下连续流动。开发了一个计算模型来评估磁操纵粒子的有效性。
内部合成的超顺磁单分散二氧化硅颗粒用于分离鱼精子和胎盘DNA。通过全面的实验评估了平台的吸附、解吸和隔离效率。我们的实验表明,在我们的平台上,DNA分离可以在10分钟内完成。
最近,我们的团队开发了柔性液压储层(FHR),用于样品加载到微流控芯片中。带有集成阀门的新版本FHR正在开发中。随着新版本FHR的实施,在手术过程中不需要更换注射器,这最终将使整个过程完全自动化。此外,我们的平台具有灵活的设计,可以根据特定应用修改FHR和微通道的体积。
因此,考虑到样品数量的灵活设计,快速分析,依赖于相对不太复杂的设备,低成本制造,以及最重要的是,具有便携式护理点测试的潜力等优秀特性,我们的平台是低成本,快速DNA分离的可行选择。进一步提高分离效率和应用我们的平台分离不同的生物材料,如细菌、病毒、外泌体等,将是我们未来的一些研究方向。
论文信息:Gnes Kibar, Buigra Sartarslan, Serkan Doganay, Gokay Yildiz, O. Berk Usta, and Barbaros Cetin.
论文链接:https://doi.org/10.1021/acs.analchem.3c04412
(责任编辑:admin)
最新内容
热点内容


 Conflux Technology 获110
Conflux Technology 获110 通用汽车向Forge Nano投资
通用汽车向Forge Nano投资 华中科技大学:增材制造Si
华中科技大学:增材制造Si 赋能汽车、医疗等行业|TP
赋能汽车、医疗等行业|TP Amnovis利用3D打印技术制
Amnovis利用3D打印技术制 国产连续纤维3D打印开拓
国产连续纤维3D打印开拓 创想三维2023全球
创想三维2023全球 上海交大谷国迎教
上海交大谷国迎教 3D打印假体植入内
3D打印假体植入内 FRI:降脂油包水
FRI:降脂油包水 少年骨折后感染致
少年骨折后感染致 打出一片“新天地
打出一片“新天地

