西京医院:3D打印、计算机建模和人工智能在结构性心脏病中的应用展望(2)
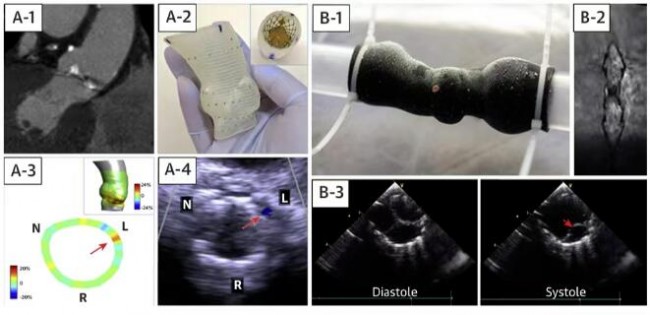
静态的3D打印模型能够大大缩短研发部门从介入治疗理念提出到临床应用的周期。此外,最新的静态3D打印技术可以在模拟患者自身血流动力学条件下,对介入瓣膜及其输送系统进行体外测试(图8)。然而,3D打印模型无法模拟心脏的生物力学特性、组织形态变化、血流动力学以及它们之间的交互作用。
注:A-1:CT获取原始数据;A-2:在3D打印的主动脉根部模型释放TAVR瓣膜;A-3:测量瓣环各处径向受力情况;A-4:预测术后瓣周漏情况;B-1:将3D模型连接到搏动血流模拟器上;B-2,3:核磁和超声检测血流状态以及瓣叶活动度。
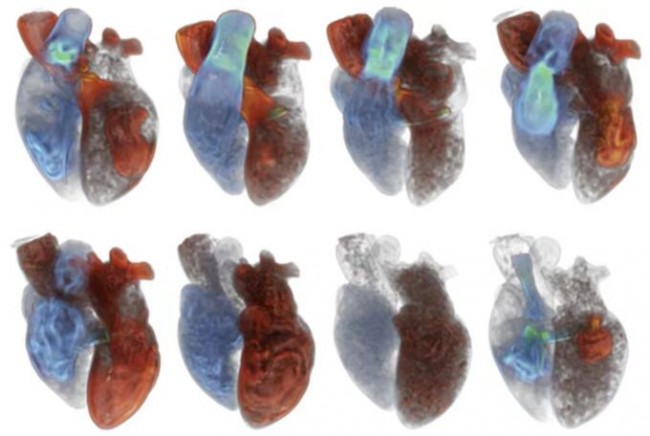
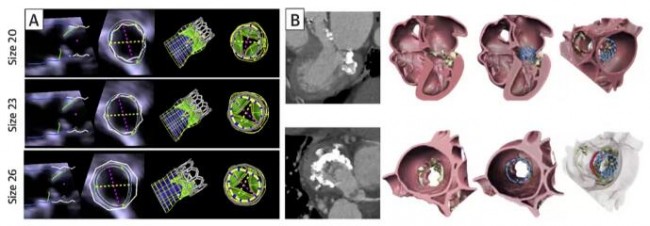
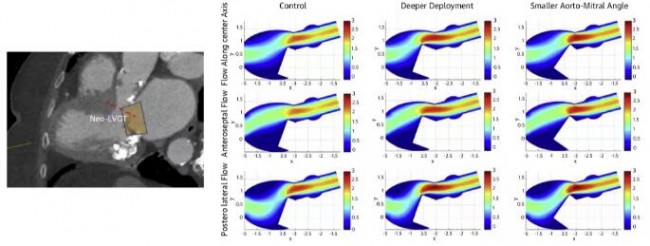
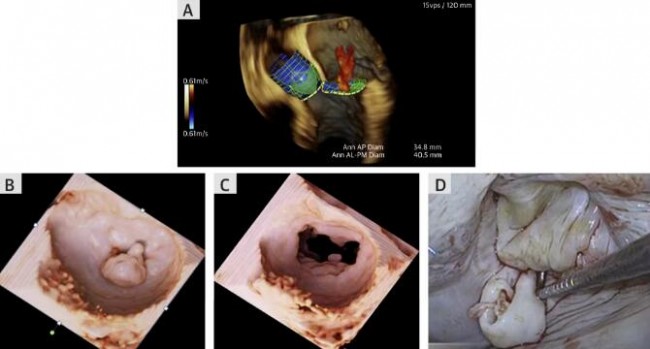
计算机建模通常可以通过有限元分析(FEA)和计算流体力学(CFD)等数值分析方法进行心脏形态和压力的量化分析,从而展示心脏血流动力学情况(图9)[19]。但计算机建模非常耗时,一般需要数小时到数天,费用较高,而且对建模简化过程中所采用简化方法和假设十分敏感。有些研究将左室心内膜假设为光滑的表面,而这种假设会导致心室内血流动力学评估出现偏差。Kulp等[20]通过对3D打印的心内膜表面补充分析肌小梁的结构,进一步完善了心室内血流的CFD模拟。结果显示,心内膜肌小梁结构对左室血流动力学有重要影响,心衰时会引起血流停滞。目前,能够用于临床的计算机建模工具(如FEA、CFD)较少,而且该技术的实施需要特殊的编程/工程技术,因此多在科研机构中使用。在临床工作中,已实现在计算机建模心脏解剖结构的基础上进行介入瓣膜的模拟植入,确定最佳瓣膜尺寸和植入深度(图10)[12,13]。在TMVR术前也可以对neo-LVOT进行评估,TMVR术后的LVOT阻塞不仅取决于neo-LVOT的解剖结构,也取决于左室血流动力学状态(图11)。
人工智能(AI)技术,或称机器学习,能够从大量的临床数据中解读出极为复杂的内在规律,在医疗行业应用前景广阔。如前文所述,SHD领域涉及大量临床数据参数(包括正在使用、未使用以及尚未测量的数据),3D结构可视化未达标准,4D生理机能在不同年龄、性别、种族的患者间存在显著差异。而人工智能(AI)技术可以有效解决上述问题,在提高患者医疗服务质量的同时降低医疗费用。
l AI技术助力SHD介入治疗
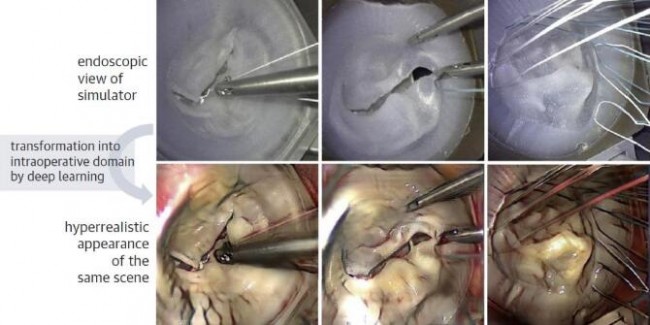
AI与3D打印技术相结合,可以打印出个体化解剖模型,进而促进精准医疗。Engelhardt等通过使用深度神经网络从腔镜视野中学习术中关键操作和步骤,展示了AI强大的微创手术培训能力。计算机网络可从腔镜二尖瓣修复手术中获取其关键特征(包括纹理不均的组织结构、血流情况、器械以及缝线使用等),从手术模拟中获取其显著特征(如瓣膜复制品的硅胶表面、器械以及缝线使用等)。AI训练的目的就是通过学习实际手术和模拟手术两者之间的映射联系,使得模拟手术的操作视野更接近于实际操作视野。该方法被称为“超现实主义”,是增强现实的一种形式,即通过产生原始图像中本不存在细节的模拟现实,来实现比真实手术更为真实的渲染效果,进而达到提升手术训练质量的目的[58]。图12展示了使用二尖瓣人工硅胶瓣膜进行介入手术训练的超现实主义。
l AI技术在介入医生和介入影像医生培训中的应用
基于超现实主义和AI模拟在医疗器械培训中展现出的潜在适应性,使得未来它们可能成为新技术蓬勃发展的基础。通过在手术模拟中集成完整的心脏瓣膜模型,AI技术能明显提升术者对手术器械操作和术中技术应用的信心[21,22]。在深度学习框架中,将AI应用于术中TEE处理,允许计算机对自动客观获得的TEE图像进行质量评估和反馈。例如,在TAVR培训的过程中,计算机通过对于术者手术操作和器械操作的自动化评估已经发现了某些客观指标(如新手和专家在操作时间、速度、加速度等方面的差异)是可被计算机复制的[22]。未来,实时3D-TEE数据与机器学习和AI的结合,将有助于提供更客观有效的介入影像医师和术者培训模式。
l AI技术的其他应用
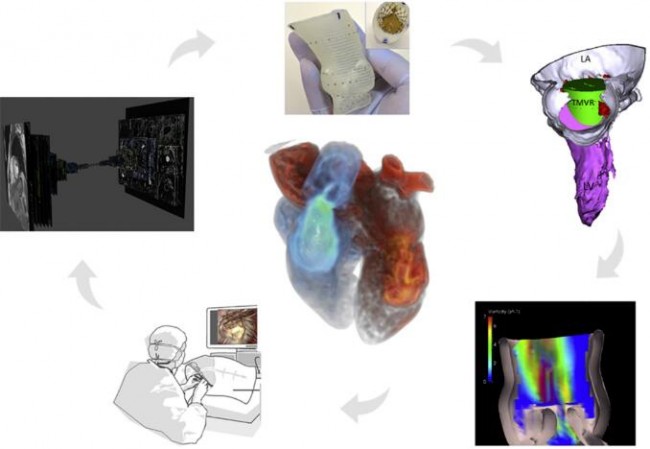
AI可用于上传、共享和检索全球众多外科医生和介入医生手术视频、术中影像和电子病历[23],创建出一个旨在提升医师实践技术水平的综合数据库。推进机器学习和AI技术的潜在好处是能够优化并生成更多的来源于实时3D TEE成像的瓣膜模型(图13)。而且AI可以帮助识别罕见的解剖结构并整合围术期各种临床数据(图14)。
注:A:实时3D TEE影像;B和C:AI通过对3D TEE影像进行色彩渲染,可清晰显示二尖瓣收缩期和舒张期P2区域腱索断裂和瓣叶脱垂;D:该病例的术中影像。
注:将3D打印技术、手术模拟、流体建模和AI整合,是将来临床培训、器械研发和精准医疗的重要发展方向。
l 需要解决和克服的技术挑战
当前,AI在实际应用中的主要挑战是大量非结构化临床数据的存在。数据收集的基础是合适的源图像、服务器之间文件转换的兼容性,以及直接上传到“学习云”的效率。一旦上传的数据被整合到“学习云”中的现有数据集中,AI算法将被激活和改进,新数据将被用来组成更精简的流程。随着新数据集被添加到其训练集中,AI 算法也将变得更加准确和高效。
在SHD介入治疗中,3D打印、计算机建模和人工智能均有重要作用。早期应用这些技术可以明显缩短新器械、新技术的学习曲线。未来的计算机建模和深度学习应用将需要将患者术中情况和患者数据安全地整合到患者病历和医疗数据采集和共享平台中。未来的多模态心血管成像需要将心血管临床知识与生物医学工程以及计算机软件开发的各类知识不断结合,这将不再仅仅是一个临床医生就能够完成的。
参考文献
[1] Wang D D, Qian Z, Vukicevic M, et al. 3D Printing, Computational Modeling, and Artificial Intelligence for Structural Heart Disease[J]. JACC Cardiovasc Imaging,2021,14(1):41-60.
[2] Jian Yang, Alex Pui-Wai Lee, Vladimiro L. Vida. Cardiovascular 3D Printing: Techniques and Clinical Application[M]. 1st Edition. Springer, 2021:145-170
[3] 杨剑,吴永健。经导管主动脉瓣置换术中的3D打印技术——应用与实践[M]。 第1版. 北京:化学工业出版社,2022:95-145
[4] Costello J P, Olivieri L J, Krieger A, et al. Utilizing Three-Dimensional Printing Technology to Assess the Feasibility of High-Fidelity Synthetic Ventricular Septal Defect Models for Simulation in Medical Education[J]. World J Pediatr Congenit Heart Surg,2014,5(3):421-426.
[5] Binder T M, Moertl D, Mundigler G, et al. Stereolithographic biomodeling to create tangible hard copies of cardiac structures from echocardiographic data: in vitro and in vivo validation[J]. J Am Coll Cardiol,2000,35(1):230-237.
[6] Mahmood F, Owais K, Taylor C, et al. Three-dimensional printing of mitral valve using echocardiographic data[J]. JACC Cardiovasc Imaging,2015,8(2):227-229.
[7] Fan Y, Yang F, Cheung G S, et al. Device Sizing Guided by Echocardiography-Based Three-Dimensional Printing Is Associated with Superior Outcome after Percutaneous Left Atrial Appendage Occlusion[J]. J Am Soc Echocardiogr,2019,32(6):708-719.
[8] Ripley B, Kelil T, Cheezum M K, et al. 3D printing based on cardiac CT assists anatomic visualization prior to transcatheter aortic valve replacement[J]. J Cardiovasc Comput Tomogr,2016,10(1):28-36.
[9] Mahmood F, Owais K, Montealegre-Gallegos M, et al. Echocardiography derived three-dimensional printing of normal and abnormal mitral annuli[J]. Ann Card Anaesth,2014,17(4):279-283.
[10] Kapur K K, Garg N. Echocardiography derived three- dimensional printing of normal and abnormal mitral annuli[J]. Ann Card Anaesth,2014,17(4):283-284.
[11] Vukicevic M, Mosadegh B, Min J K, et al. Cardiac 3D Printing and its Future Directions[J]. JACC Cardiovasc Imaging,2017,10(2):171-184.
[12] Wang D D, Eng M, Greenbaum A, et al. Predicting LVOT Obstruction After TMVR[J]. JACC Cardiovasc Imaging,2016,9(11):1349-1352.
[13] Wang D D, Eng M H, Greenbaum A B, et al. Validating a prediction modeling tool for left ventricular outflow tract (LVOT) obstruction after transcatheter mitral valve replacement (TMVR)[J]. Catheter Cardiovasc Interv,2018,92(2):379-387.
[14] Wang D D, Eng M, Kupsky D, et al. Application of 3-Dimensional Computed Tomographic Image Guidance to WATCHMAN Implantation and Impact on Early Operator Learning Curve: Single-Center Experience[J]. JACC Cardiovasc Interv,2016,9(22):2329-2340.
[15] Avenatti E, Barker C M, Little S H. Tricuspid regurgitation repair with a MitraClip device: the pivotal role of 3D transoesophageal echocardiography[J]. Eur Heart J Cardiovasc Imaging,2017,18(3):380.
[16] Muraru D, Veronesi F, Maddalozzo A, et al. 3D printing of normal and pathologic tricuspid valves from transthoracic 3D echocardiography data sets[J]. Eur Heart J Cardiovasc Imaging,2017,18(7):802-808.
[17] Harb S C, Rodriguez L L, Svensson L G, et al. Pitfalls and Pearls for 3-Dimensional Printing of the Tricuspid Valve in the Procedural Planning of Percutaneous Transcatheter Therapies[J]. JACC Cardiovasc Imaging,2018,11(10):1531-1534.
[18] Cabasa A S, Eleid M F, Rihal C S, et al. Tricuspid Valve Replacement: A Percutaneous Transfemoral Valve-in-Ring Approach[J]. JACC Cardiovasc Interv,2015,8(8):1126-1128.
[19] Wang Q, Primiano C, Mckay R, et al. CT image-based engineering analysis of transcatheter aortic valve replacement[J]. JACC Cardiovasc Imaging,2014,7(5):526-528.
[20] Kulp S, Gao M, Zhang S, et al. Using high resolution cardiac CT data to model and visualize patient-specific interactions between trabeculae and blood flow[J]. Med Image Comput Comput Assist Interv,2011,14(Pt 1):468-475.
[21] Engelhardt S, Sauerzapf S, Brcic A, et al. Replicated mitral valve models from real patients offer training opportunities for minimally invasive mitral valve repair[J]. Interact Cardiovasc Thorac Surg,2019,29(1):43-50.
[22] Mazomenos E B, Chang P L, Rippel R A, et al. Catheter manipulation analysis for objective performance and technical skills assessment in transcatheter aortic valve implantation[J]. Int J Comput Assist Radiol Surg,2016,11(6):1121-1131.
[23] Hashimoto D A, Rosman G, Rus D, et al. Artificial Intelligence in Surgery: Promises and Perils[J]. Ann Surg,2018,268(1):70-76.
l 作者
毛予、翟蒙恩、金屏、刘洋、杨剑
(责任编辑:admin)


 Conflux Technology 获110
Conflux Technology 获110 通用汽车向Forge Nano投资
通用汽车向Forge Nano投资 华中科技大学:增材制造Si
华中科技大学:增材制造Si 赋能汽车、医疗等行业|TP
赋能汽车、医疗等行业|TP Amnovis利用3D打印技术制
Amnovis利用3D打印技术制 国产连续纤维3D打印开拓
国产连续纤维3D打印开拓 创想三维2023全球
创想三维2023全球 上海交大谷国迎教
上海交大谷国迎教 3D打印假体植入内
3D打印假体植入内 FRI:降脂油包水
FRI:降脂油包水 少年骨折后感染致
少年骨折后感染致 打出一片“新天地
打出一片“新天地

