利用SUNP BP11低温沉积3D打印含多级孔隙结构
时间:2022-09-16 18:57 来源:上普生物 作者:admin 阅读:次

背景介绍
支架材料是骨组织工程的重要组成部分,其必须满足与天然骨匹配的生物活性和力学性能。细胞粘附和羟基磷灰石(HA)矿化是骨形成的关键生物学阶段。针对第一个阶段,具体策略有使用表面含纳米孔的支架促进细胞粘附,扩散和成骨分化,此外,向支架外开放和相互连接的孔(数百微米)有利于营养物质和生长因子的运输,进一步促进支架内部的细胞生长,血管化和废物代谢。即具有纳米至微米尺度孔的多孔支架在骨形成的早期阶段是有效的。针对第二个阶段,已经发表了许多解释生物矿化的假说阐述生物矿物沉积在成骨过程中是至关重要的,包括大分子识别、模板控制、成骨细胞介导、静电吸附等。因此,诱导羟基磷灰石矿化的功能性生物材料具有重要意义。
聚醚醚酮(PEEK)是一种高性能的半结晶性树脂,其弹性模量类似于天然骨骼。由于其优异的力学性能、耐化学性和生物相容性,聚醚醚酮是临床骨科和脊柱应用的主要组成部分。然而,PEEK 在生物学上是惰性的,不利于与周围骨组织的预期结合,阻碍了正常的骨生长。为了解决这一问题,研究人员开发了包括表面修饰和复合材料的制备在内的多种方法,来改善 PEEK植入物的骨整合。然而,PEEK具有芳香族分子骨架,在芳基环之间有酮和醚官能团,密集排列在聚合物链之间。这些特殊的分子结构使得 PEEK 具有较好的稳定性,难以进行改性。当然,聚醚醚酮的表面可以被腐蚀性酸(例如浓硫酸)腐蚀,因此转变为多孔结构。然而,腐蚀性酸很难完全清除,因此残留的有毒成分会导致细胞和组织损伤。另一种修饰策略是在 PEEK 表面接枝官能团。然而,这一过程过于冗长均一性差。此外,将生物活性材料(如纳米羟基磷灰石颗粒)浸渍到聚醚醚酮(PEEK)复合材料中已经成为一种提高 PEEK 生物活性的高效方法。然而,由于界面粘结力差,添加剂活性材料的复合材料中容易出现界面失效和疲劳损伤,随后基体裂纹从填料-基体结合部位开始萌生和扩展。随后,较短的裂纹发展成为较长的基体裂纹从而来,从而破坏结构。PEEK 表面上的生物活性涂层是另一种有效的方法,一些生物活性因子(如抑菌剂)可以被装载到涂层中,并在植入体内时释放起积极作用,从而赋予惰性 PEEK 植入物生物活性。
本文基于活性涂层的理念提出并合成了一种含羧基的无定形聚芳醚酮(PAEK-COOH),它是通过亲核取代反应缩聚反应合成的。该聚合物溶于有机溶剂通过SUNP ALPHA-BP11低温沉积3D打印机一步制备 PAEK-COOH 多级孔隙支架材料,力学强度与松质骨相似,支架具有从纳米到微米尺度可控的微观结构。相比于熔融沉积成型(FDM)打印的 PEEK 支架,低温沉积打印的 PAEK-COOH 支架具有纳米孔表面促进细胞粘附和羧基通过静电相互作用诱导 HA 矿化,加速体内骨形成(图1)。
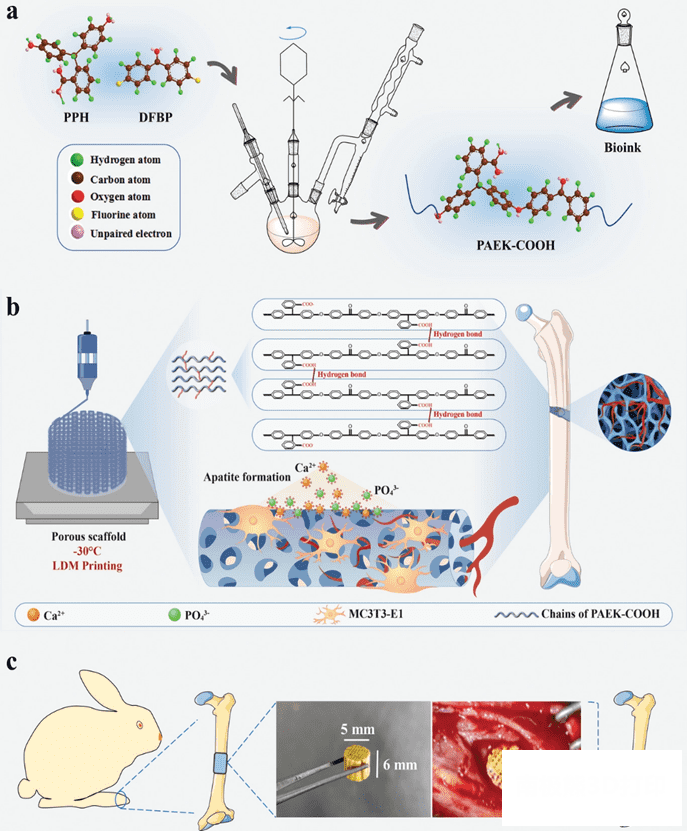
图1. 研究路线示意
a) PAEK-COOH的合成工艺及打印墨水制备。b)低温沉积打印PAEK-COOH 多级孔隙支架,有利于细胞粘附和羟基磷灰石矿化。c)植入的支架在体内诱导骨形成。
实验过程与结果
1. 材料合成与可打印性表征
以苯酚酞(PPH)和4,4’-二氟二苯甲酮(DFBP)在二甲基亚砜(DMSO)中进行亲核取代反应缩聚反应,并以二甲基亚砜(K2CO3)为催化剂合成了 PAEK-COOK (图2),经盐酸酸化后获得 PAEK-COOH。在 X 射线衍射分析(XRD)图样(图2b)中,在≈20度处出现一个单峰和宽峰,表明 PAEK-COOH 是一种无定形聚合物。这是由于侧链的苯环和羧基破坏了聚合物链的规则性。由于存在侧链,溶剂(例如1,4-二氧六环)可以轻易穿透聚合物内部,因此无定形的 PAEK-COOH 可以溶解在1,4-二氧六环中(图2b)。随后,可以通过调节溶剂获得不同的生物墨水浓度(包括 PAEK-COOH 和1,4-二氧六环)(图2e)用于满足可打印性的要求。
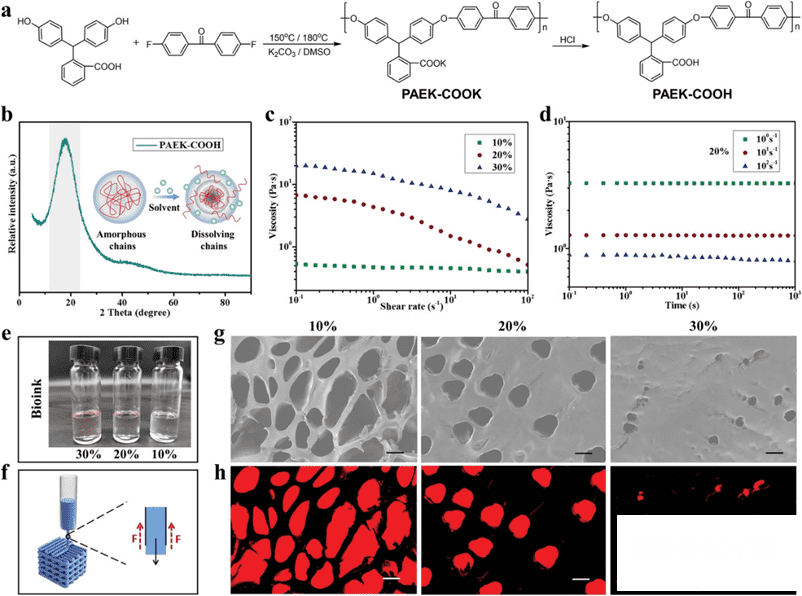
图2.PAEK-COOH 的合成及生物墨水的可打印性。a)通过亲核取代反应缩聚反应合成
PAEK-COOH 的方案。b) PAEK-COOH 的 XRD
谱图和溶剂溶解聚合物链的示意图。c)在剪切速率范围内(10-1-102s-1)生物油墨的表观粘度。d)在不同剪切速率下,1000s内生物墨水的流变特性(浓度为20%g
mL-1)。e)不同浓度的生物墨水(单位: g mL-1)的照片。f)3D 打印过程中的流变剪切力示意图(F:
剪切力)。g)通过扫描电镜观察不同浓度墨水所得支架的孔隙分布和尺寸大小,经Image J处理得到图h)。比例尺 = 20微米。
2. 含多级孔隙骨支架制造及其性能表征
含多级孔隙骨支架是通过SUNP ALPHA-BP11低温沉积3D打印机制备的。打印过程中材料在足够的冷冻温度下将缝隙中的溶剂转化为冰晶。在特定的温度和压力的后续冻干程序中,冰晶升华成蒸汽,残留溶剂被消除,产生多孔支架,该技术可以制造任何形状的个性化支架(图3a,b)。值得一提的是,该技术同样可以打印具有梯度结构的多孔支架(图3b),模仿真实的骨结构。
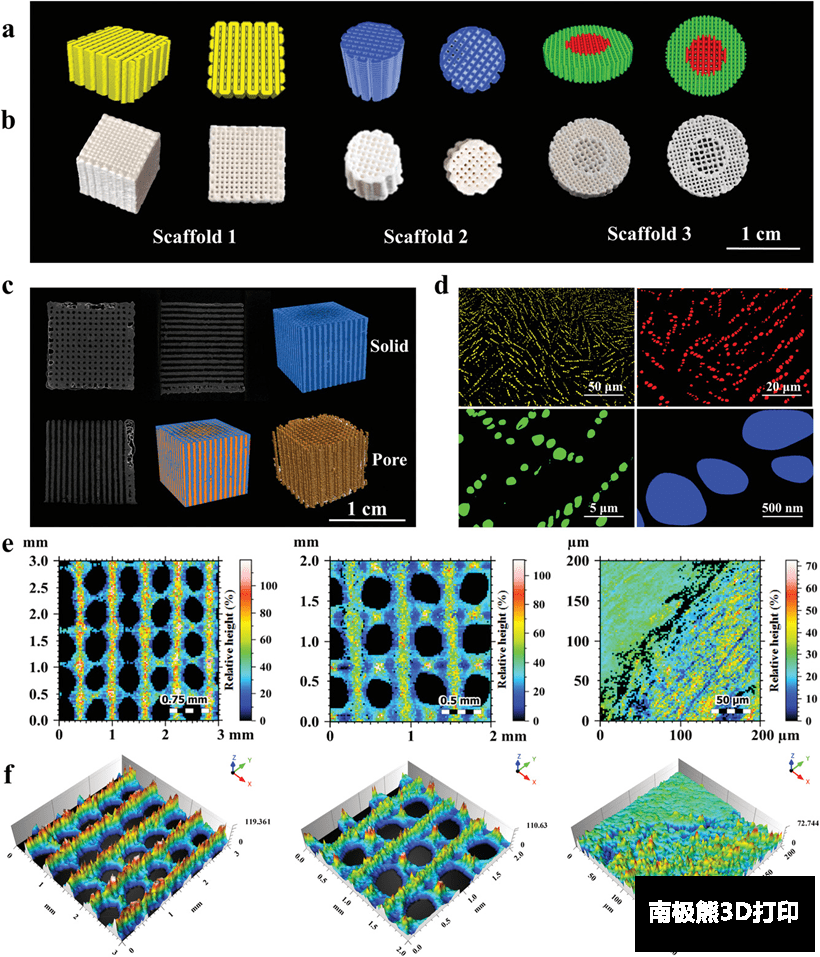
图3. 从宏观到微观的3D打印多级孔隙支架结构。a)由
BioMakerV2设计的多孔支架的三维模型。b) 以PAEK-COOH为基体材料的3D打印多孔支架。c)支架的二维切片及显微 CT
扫描后的三维重建结构。d)Image J处理的不同结构孔隙的扫描电镜图像和表面轮廓仪扫描获得的2D e)和 3D f)表面形貌图像。
通过熔融沉积成型(FDM)方法制造聚醚醚酮(PEEK)支架,以便与低温沉积打印的PAEK-COOH 支架进行比较。表面 SEM 图像显示了支架之间的差异:首先,这两种支架在低放大倍率都呈现出规则的外观为正交排列的纤维,然而在高倍放大的影像中,低温沉积支架呈现出多孔结构,这是由于在冷冻干燥过程中溶剂被移除的。AFM 图像验证了这些表面微观结构差异。由于材料表面微观结构的差异,材料的比表面积和亲水性获得提高。与FDM支架(111.08°± 3.85°)相比,LDM支架(80.54°±2.45°)的水接触角显着降低(图4d)。这是因为纳米孔表面和羧基的存在改善了支架的亲水性。此外,与 FP 相比,LP 支架表现出较低的密度和较大的细胞粘附的比表面积(图4e)。除了生物活性,支架的力学性能也应该与真实骨骼相匹配,从而防止应力屏蔽。在相同的孔隙率下(图4c,f) ,LDM支架的压应力(6.15MPa±0.45MPa)与松质骨(2-12MPa)显着匹配。
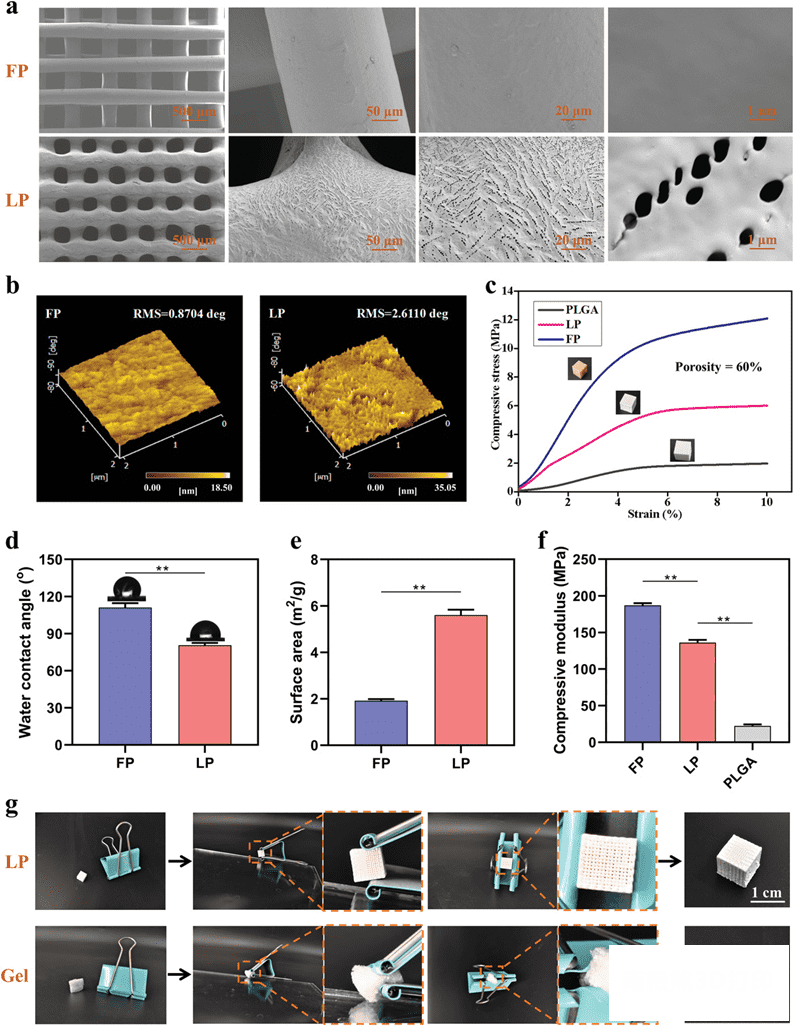
图4.
不同支架结构和性能的比较。A)熔融沉积组和低温沉积组支架在不同放大倍数下的扫描电镜图像。b)利用原子力显微镜进行三维表面粗糙度测量(RMS:均方根)。c)
熔融沉积组,低温沉积组,纯PLGA材料组支架压缩应力-应变曲线 (压缩速度:1mm/min)。d)接触角比较。e)比表面积比较(BET
法计算)。F)具有相同孔隙率的熔融沉积组,低温沉积组,纯PLGA材料组支架的压缩模量。g)采用同一夹具挤压低温沉积支架和冻干GelMA凝胶支架。每组
n = 5。* * P < 0.01.
3. 利用体外实验观察支架对成骨细胞行为的调控
根据 SEM 图像的观察,我们注意到在不同支架上培养的MC3T3-E1细胞的细胞粘附和扩散形态有相当大的变化(图5a-d)。具体来说,LDM支架表面纳米多孔结构使细胞呈现典型的多边形和相对拉伸的形态,大量的细胞丝状伪足与基质支架紧密相连。纳米孔类似于细胞丝状伪足的附着点,调控细胞行为。之后,在LDM支架表面纳米孔作用下,MC3T3-E1沿着支架纤维粘附和迁移。尽管如此,然而在熔融沉积支架表面没有观察到类似状态,仅观察到具有少量突起的近球形细胞,并且一些细胞凋亡。
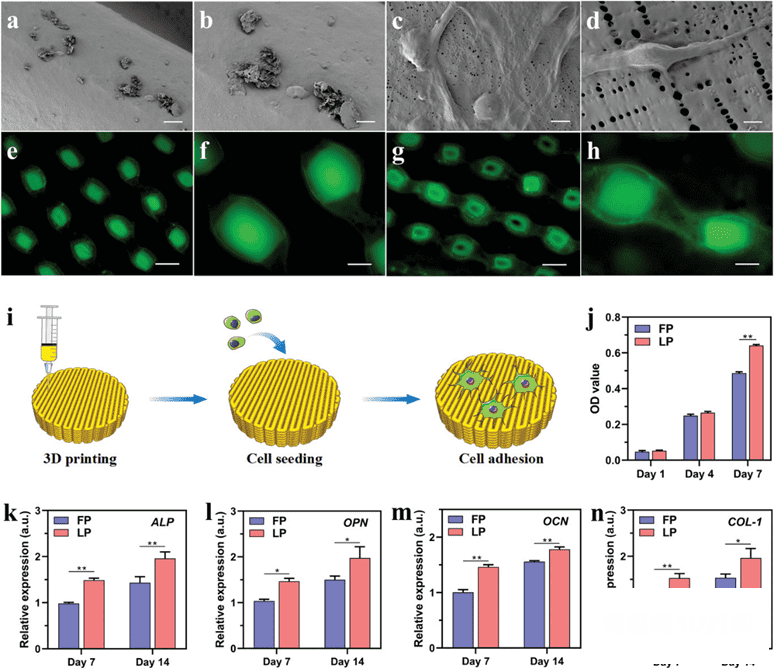
图5. 具有纳米孔表面的低温沉积支架促进细胞附着。a-d) SEM 图像显示24小时后在熔融沉积
(a,b)和 低温沉积 (c,d)支架上培养的 MC3T3-E1细胞的细胞扩散形态。比例尺 = 20μm (a,c)和5μm
(b,d)。e-h) 共聚焦扫描图像显示3天后通过活/死亡测定在熔融沉积 (e,f)和低温沉积(g,h)支架上培养的
MC3T3-E1细胞的细胞分布。比例尺 = 200μm (e,g)和50μm (f,h)。i)细胞行为的示意图,接种后粘附在支架上。j)
MC3T3-E1细胞在不同3D 打印支架上的增殖差异。k-n)成骨相关基因(ALP,OPN,OCN,COL-1)的相对表达。每组 n = 3。*
P < 0.05,* * P < 0.01.
4. 支架诱导羟基磷灰石矿化原理分析
在模拟体液(SBF)中浸泡后,X射线光电子能谱(XPS)被用来分析支架上的元素含量。1天后,在 LDM支架上观察不到明显的 Ca 2p 和 P 2p 峰,2天后,LDM支架光谱出现了 Ca2p 峰,但没有高分辨率的 P2p 峰,3天后,光谱中出现了强烈的 Ca2p 和 p2p 峰,意味着支架表面形成了磷酸钙团聚体(图6b,c)。研究结果表明,在LDM支架上富集的羧基促进了 HA 晶体在模拟体液环境中的成核。这与胶原细胞外间质的自然骨形成相似。这是由于PAEK-COOH 的羧基电离而产生负电荷吸引下带正电荷的钙离子,随着钙离子的逐渐积累,支架表面获得正电荷,并选择性地吸附带负电荷的磷酸根离子形成包含磷酸钙的不均匀成核,继续自发生长后,成为稳定的骨样羟基磷灰石晶体。
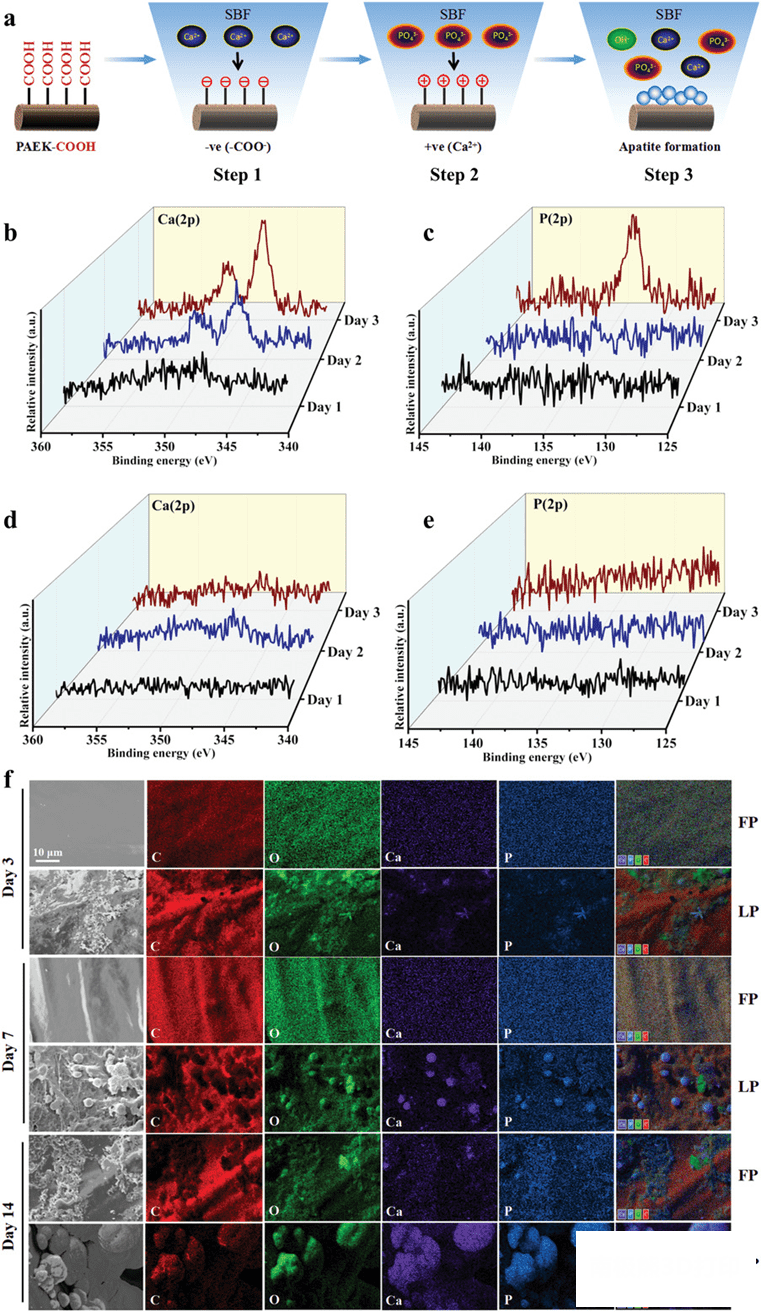
图6.模拟体液中羟基磷灰石矿物的形成。a)静电吸附促进羟基磷灰石在低温沉积支架上沉积的机理。X 射线光电子能谱(XPS)测量一定浸泡时间后低温沉积支架上的 b Ca2p和c) P2p分布,及对应元素在熔融沉积支架上的分布d),e);f)羟基磷灰石沉积在熔融沉积和低温沉积支架表面的SEM图像和EDS分析。
5. 兔体内实验验证骨修复效果
低温沉积支架周围的新骨组织比熔融沉积支架更丰富。此外,HE 染色结果(图7i)表明,新的骨组织在4周后开始在支架表面生长,在8周后在支架周围形成大量的新骨组织,Goldner 三色染色结果(图7j)表明低温沉积支架组在支架周围充满了大量的矿化(蓝绿色)骨组织。即低温沉积打印形成的支架由于其优良的骨诱导能力,可以有效地促进骨再生,在缺损区域形成更好的新骨组织的骨连接。
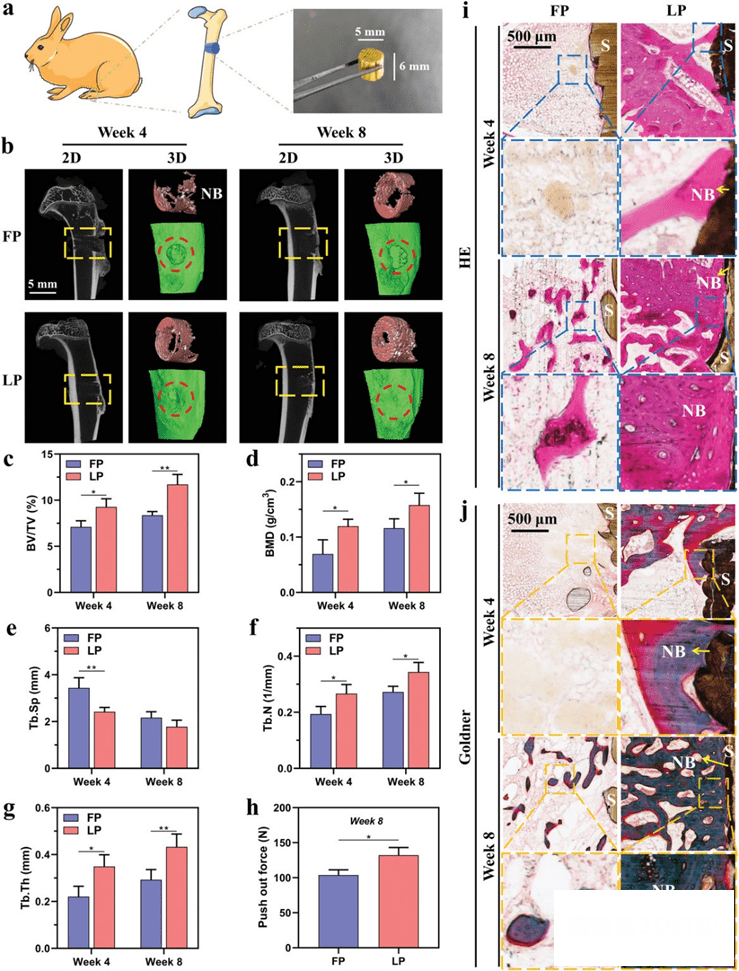
图7. 体内骨再生分析。a)直径5毫米、深度6毫米的支架植入过程示意图。b)二维和三维的micro
CT重建图像显示植入熔融沉积和低温沉积打印支架两组的骨再生情况。(新形成的骨组织呈现红色)。c-g)通过测量(c)骨体积分数,(d)骨矿化程度,(e)骨小梁分离,(f)骨小梁数和(g)
骨小梁厚度来定量分析再生骨组织。h)8周后不同支架的拉脱力。i,j) HE和戈德纳染色图像显示骨修复周围的缺损处理与不同的支架。(S: 支架;
NB: 新形成的骨组织; 黄色箭头表示沿支架新形成的骨)。每组 n = 3。* P < 0.05,* * P < 0.01.
结论
该研究通过SUNP BP11低温沉积3D打印机成功地制备了具有多级孔隙的PAEK-COOH 骨修复支架。该支架具有从纳米级到微米级的可控微结构,力学强度满足承重骨小梁的要求。含纳米孔的支架表面能促进细胞粘附、扩散、分化,提高成骨能力。同时由于支架表面带负电的羧基与钙离子之间存在静电引力相互作用,有利于羟基磷灰石晶体的形成。植入兔体内缺损部位的低温沉积支架具有更丰富的新生骨组织和更高的骨矿化度,表明其能有效促进骨再生,并能在缺损区域形成新骨组织的良好骨连接。尽管该方法显示出显著的优势,但仍然存在一些局限性。骨形成是一个复杂的过程,该研究只考虑了细胞行为和生物矿化的影响,未讨论其他关键因素,如免疫调节和血管化。
值得一提的是,该公众号上期推文3D-printed scaffold with halloysite nanotubes laden as a sequential drug delivery system regulates vascularized bone tissue healing中研究了促血管生成对骨修复的关键作用,且使用工具同为SUNP BP11低温沉积3D打印机。这两篇研究分别地从微观物理拓扑结构,生物矿化和生物化学因子诱导的方面证明了低温沉积支架在骨组织工程方面的独特优势,供读者参考。
参考文献
Gao X, Wang H, Luan S, et al. Low‐Temperature Printed Hierarchically Porous Induced‐Biomineralization Polyaryletherketone Scaffold for Bone Tissue Engineering[J]. Advanced Healthcare Materials, 2022: 2200977.
https://doi.org/10.1002/adhm.202200977
(责任编辑:admin)
最新内容
热点内容


 Conflux Technology 获110
Conflux Technology 获110 通用汽车向Forge Nano投资
通用汽车向Forge Nano投资 华中科技大学:增材制造Si
华中科技大学:增材制造Si 赋能汽车、医疗等行业|TP
赋能汽车、医疗等行业|TP Amnovis利用3D打印技术制
Amnovis利用3D打印技术制 国产连续纤维3D打印开拓
国产连续纤维3D打印开拓 创想三维2023全球
创想三维2023全球 上海交大谷国迎教
上海交大谷国迎教 3D打印假体植入内
3D打印假体植入内 FRI:降脂油包水
FRI:降脂油包水 少年骨折后感染致
少年骨折后感染致 打出一片“新天地
打出一片“新天地

