中科院科学家在改良的生物打印机上3D打印出正在跳动的心脏
时间:2022-02-25 11:07 来源:南极熊 作者:admin 阅读:次
导读:生物3D打印(3D Bioprinting)技术利用3D打印机将含有细胞和生物材料的生物墨水(Bioink)打印出特定的形状结构,是最有希望实现在体外制造人类器官的新兴技术之一。然而,目前的生物3D打印机技术还无法制造具有生理功能且能够长期存活的复杂器官,其主要原因是现有的生物3D打印机只能在水平和竖直方向上“逐层累加”地打印细胞,无法实现细胞和血管网络的有机融合,从而导致打印后的细胞缺少营养供给而难以长期存活。此外,为使逐层打印的生物墨水能够快速固定成型,现有生物3D打印技术均需在生物墨水中添加可固化的生物材料,这些材料虽然可以在短时间内固定细胞,但会显著影响细胞存活和功能。
为解决上述问题,来自中国科学院遗传与发育生物学研究所王秀杰团队与英国曼彻斯特大学教授王昌凌(Charlie C.L. Wang)团队、清华大学教授刘永进团队合作,创造性地将六轴机器人改造成为生物3D打印机(六轴机器人生物打印机)。
利用改造后的生物打印机,研究人员能够制造出一个复杂形状的血管支架,而不会造成细胞损伤或阻止细胞生长和功能,这是目前生物打印方法的常见挑战。通过3D生物打印的血管化心脏组织可以在6个月内保持活力和跳动,表明它有望成为未来生物打印功能组织和器官的一种可行方法。研究团队还设计了一种可重复打印的生物打印方法,可以生成含有血管网络的复杂组织或器官,且具备长期生存能力和关键功能。
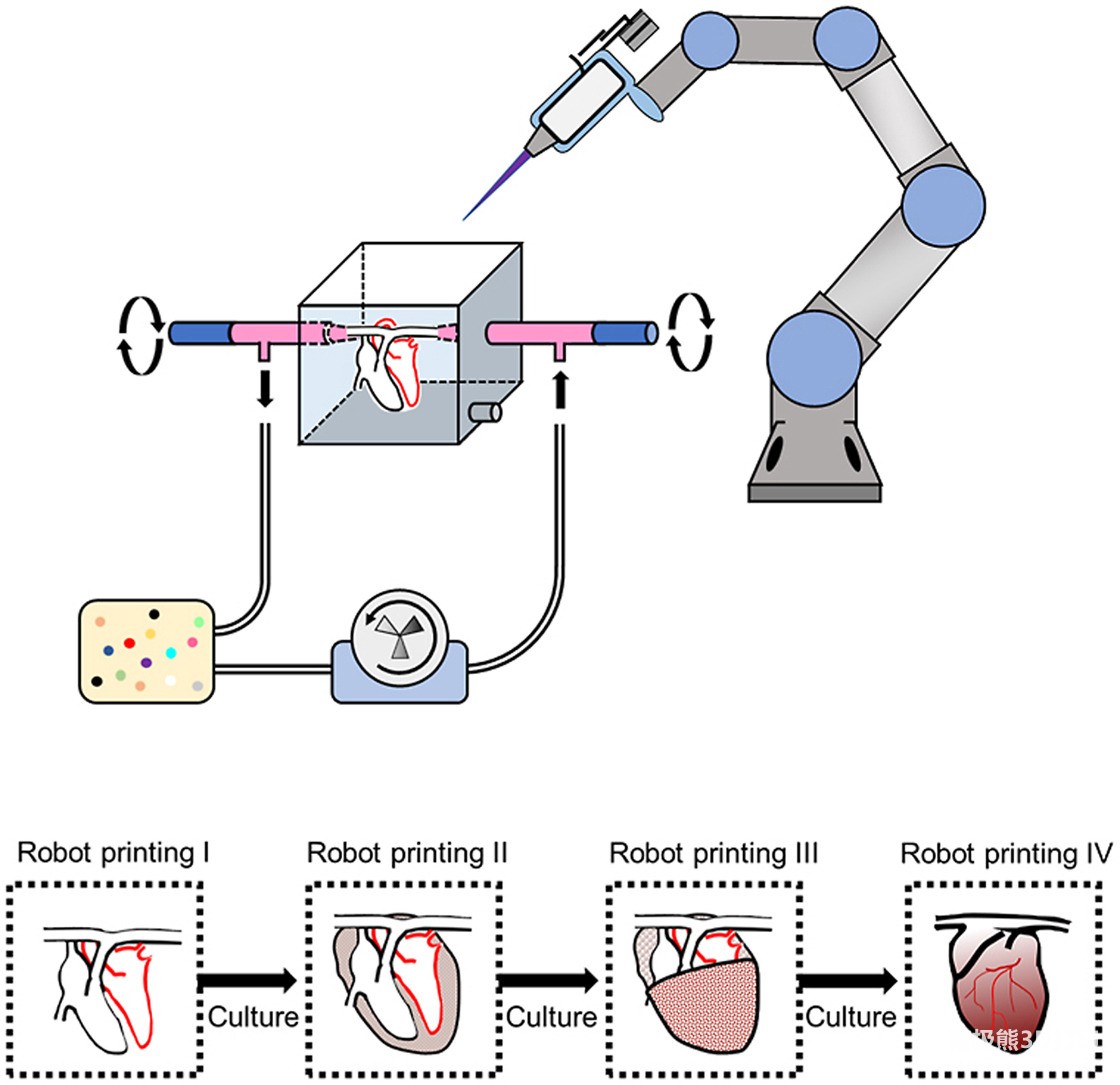
中科院研究人员的新型生物打印平台。图片来自生物活性材料。
3D生物打印组织
近10年来,3D生物打印技术在开发可行的病人特定组织方面取得了重大进展。虽然距离完全打印的器官仍有一定的距离,但一些生物打印公司和研究团队已经在正确的方向上取得了显著的成绩。例如,3D打印机制造商3D Systems公司在收购了生物打印技术开发商Volumetric biotechnologies公司后,正在扩大其生物打印项目,而生物打印初创公司Brinter正在寻求通过其新的入门级3D打印机Brinter Core来打开生物打印的可及性。在其他地方,再生医学公司CTIBIOTECH已经发布了一个新的3D生物打印平台,为结肠癌患者提供个性化的药物。
生物打印领域在专利技术方面的也不断有着新的突破,BICO最近获得了两项新的3D打印热敏生物技术的专利,再生医学公司Matricelf获得了特拉维夫大学正在申请专利的3D生物打印技术,用于器官和组织植入。最近,生物工程初创公司TrestleBiotherapeutics获得了一项新的3D生物打印技术的许可,该技术可以制造出功能性的人类肾脏组织。
最近,在再生医学上出现了专门用于生物打印血管的新生物墨水,成功地3D打印出活体脑细胞,以及能够制造功能性生物打印肝脏的新容积式3D打印工艺。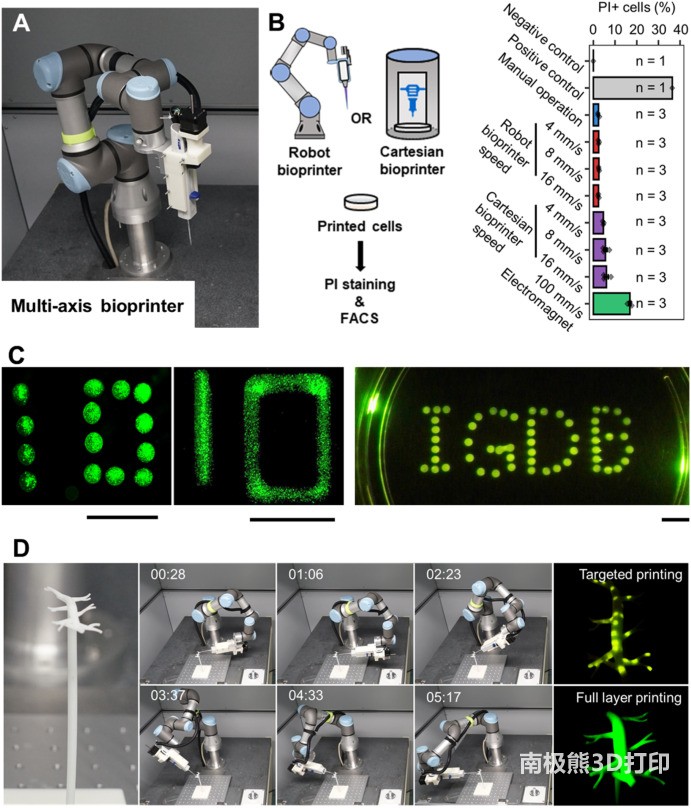
六轴机器人生物打印机不会对细胞造成损害,并支持多维细胞打印。图片来自Bioactive Materials。
新型生物打印平台
在他们的最新研究中,中科院的研究人员试图克服目前在生物打印过程中血管网络整合的挑战。目前的大多数技术依赖于通过向生物墨水中添加人工生物材料来固定打印的细胞,这可能会抑制细胞功能和新血管的形成,这反过来又降低了打印结构的生物功能及其长期生存能力。
该团队首先将一个六轴机械臂改装为3D生物打印机,以实现从各个方向打印细胞。为了避免生物材料的凝固,研究人员还设计了一个基于油浴的细胞打印系统,通过疏水性,或排斥水的过程,将打印的细胞转化为血管支架。这意味着血管支架能更好地保持其细胞活性,同时也能促进细胞间接触的形成。
随后,团队利人员用改装的生物打印机和油浴设计了一种可重复打印和可进行细胞培养的生物打印策略,其灵感来自于自然器官的发育过程。他们将单层和多层细胞打印到血管支架上,并在一定时间内进行培养,以诱导细胞间接触的形成和新血管的生长。然后,对支架和已经打印的细胞进行新一轮的生物打印。
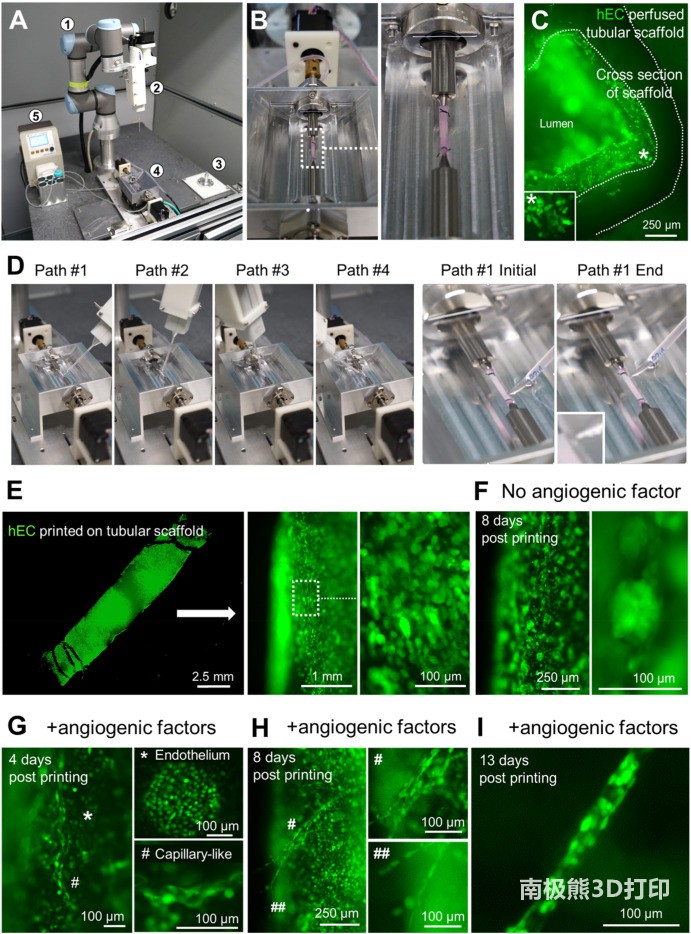
3D打印的人造血管能够进行血管生成和脉管生成。图片来自生物活性材料。
生物打印一个跳动的心脏
研究人员认为,从理论上讲,他们的打印和培养过程可以制造出功能复杂的组织,甚至是完整的器官,这些组织与血管网络相连,能够长期存活。
研究团队通过3D打印一块血管化的心脏组织证明了他们的想法,该组织保持了有节奏的跳动,并被认定为可以存活至少六个月。然后,他们建立了一个双机器人平台,以便在复杂形状的血管支架上同时实现多种类型细胞的生物打印。
展望未来,研究人员认为他们的新型生物打印平台突破了传统生物3D打印的平层局限,为在体外环境中制造大规模和功能性人工组织和器官提供了一个潜在的新策略。
关于这项研究的更多信息可以在《生物活性材料》杂志上发表的题为:"Amulti-axis
robot-based bioprinting system supporting natural cell
functionpreservation and cardiac tissue
fabrication"的论文中找到。这项研究的共同作者是Zhang, C. Wu, C. Dai, Q. Shi, G. Fang, D.
Xie, X. Zhao, Y. Liu, C.Wang, 和X. Wang。

相关论文链接:https://www.sciencedirect.com/sc ... 22000743?via%3Dihub
(责任编辑:admin)
最新内容
热点内容


 Conflux Technology 获110
Conflux Technology 获110 通用汽车向Forge Nano投资
通用汽车向Forge Nano投资 华中科技大学:增材制造Si
华中科技大学:增材制造Si 赋能汽车、医疗等行业|TP
赋能汽车、医疗等行业|TP Amnovis利用3D打印技术制
Amnovis利用3D打印技术制 国产连续纤维3D打印开拓
国产连续纤维3D打印开拓 创想三维2023全球
创想三维2023全球 上海交大谷国迎教
上海交大谷国迎教 3D打印假体植入内
3D打印假体植入内 FRI:降脂油包水
FRI:降脂油包水 少年骨折后感染致
少年骨折后感染致 打出一片“新天地
打出一片“新天地

