基于多材料投影光固化生物3D打印机,3D打印细胞自组装血管
时间:2023-01-10 10:12 来源:EngineeringForLife 作者:admin 阅读:次
近期,Berlin Institute of Health at Charité 的Isabel Orellano在AFM上发表了题为“Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement”的文章,报道了一种使用基于多材料投影立体光刻生物3D打印机和一种创新的生物材料系统来控制微血管结构的几何形状。在该框架内,HUVECs、hMSCs和人真皮成纤维细胞(hdFs)作为支持细胞类型相互作用,研究其血管生成和血管生成行为。
生物3D打印以特殊设计的方式将细胞和生物相容性材料结合起来,为设计血管化结构提供了机会。然而,微血管动态网络的复杂性仍然难以通过复杂的3D制造重现。理想情况下,可利用内皮细胞的天然组织能力,使工程血管网络自我组装,形成复杂、可控的微血管模式。研究人员提出了一种生物工程的方法来控制微血管结构的形成,并引导内皮细胞和支持细胞在多材料光固化打印结构中实现自我组装。生物工程血管化结构是通过受控的细胞沉积在酶可降解或不可降解的材料中产生的。在体外,微血管结构在分布、血管网方向、血管长度和分支行为、发育的管腔、血管稳定的迹象和包括吻合在内的相互连接的血管网中受到调节。这种新型的生物构建方法展示了通过使用细胞和空间线索来生成清晰而精确的血管化结构来控制微血管网络形成的能力。这种控制微血管形成的新方法可能在血管化植入物或体外筛选模型的开发中发挥基本作用。
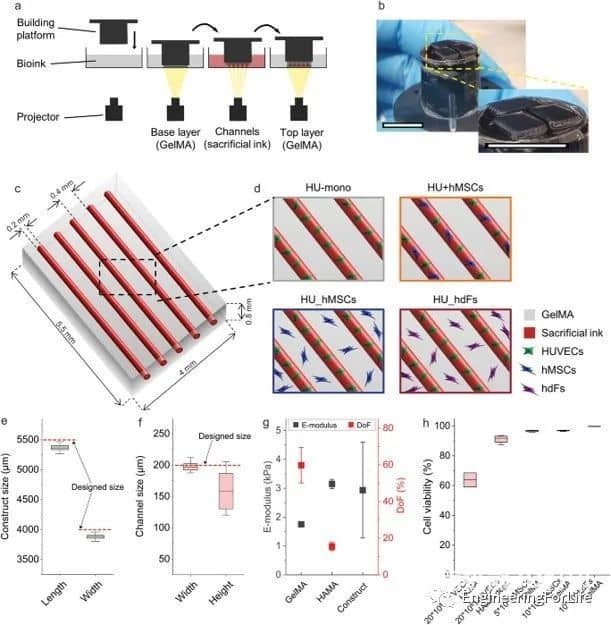
图1 3D生物打印血管化结构的实验设置
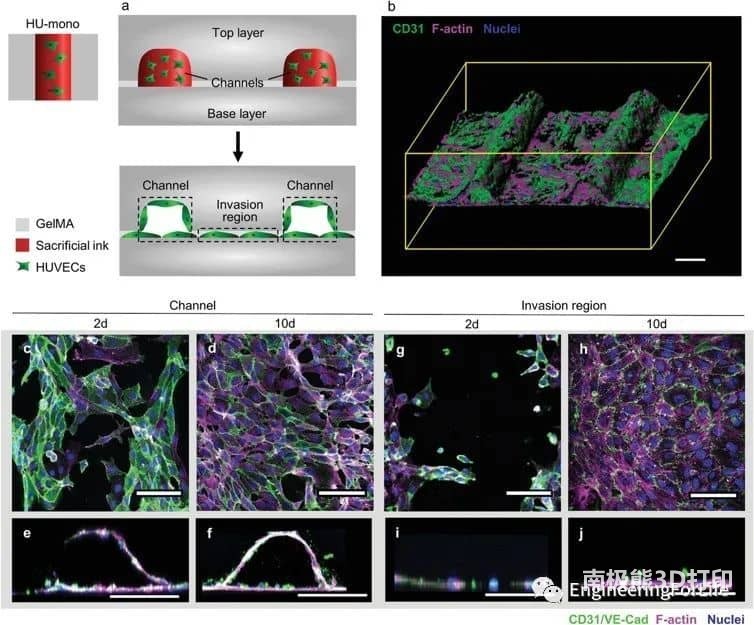
图2 HUVECs (HU‐mono)通过内皮衬里形成大血管通道情况下的细胞行为
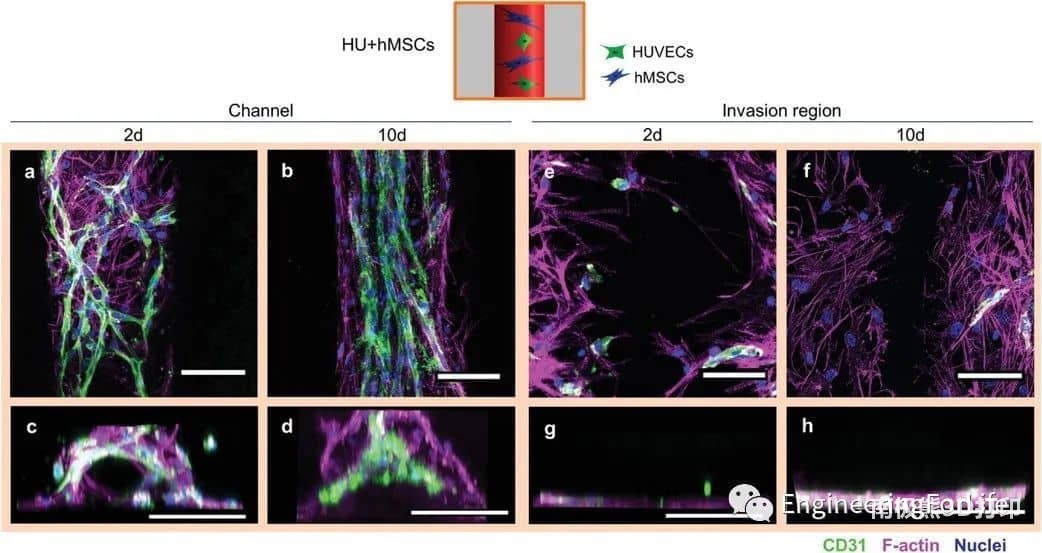
图3 HUVECs与hMSCs在通道内近距离排列(HU+hMSCs组)。
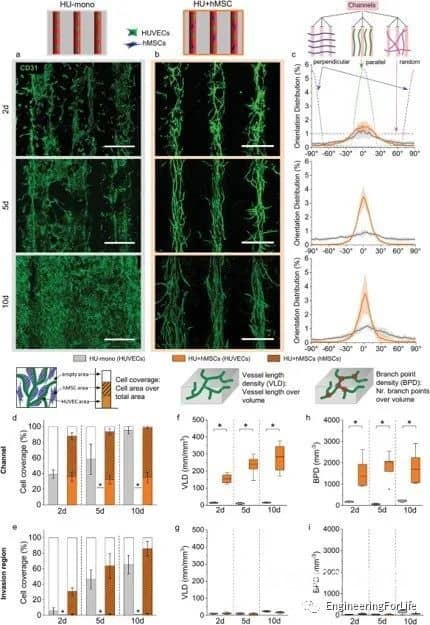
图4 随着第二种细胞类型的加入而形成的结构化微血管网
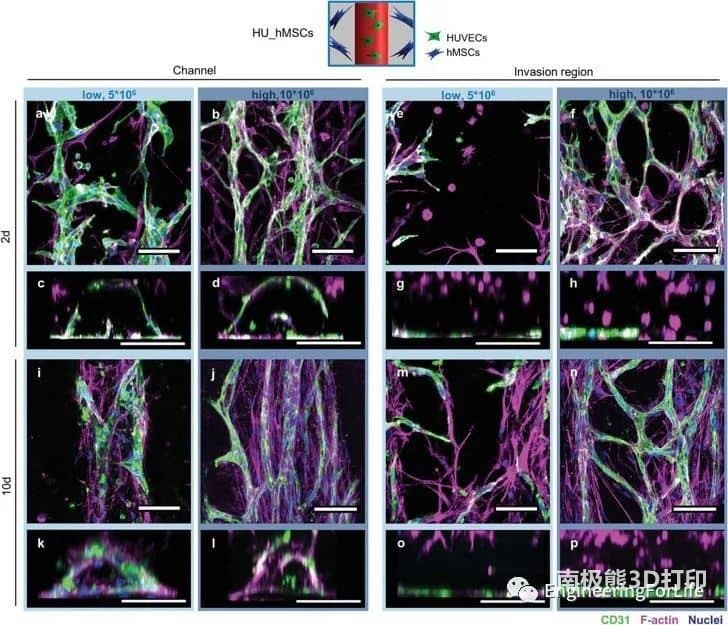
图5 不同hMSC浓度(HU_hMSCslow和HU_hMSCshigh)局部打印的HUVECs(绿色)和hMSCs(品红)的细胞行为相互分离
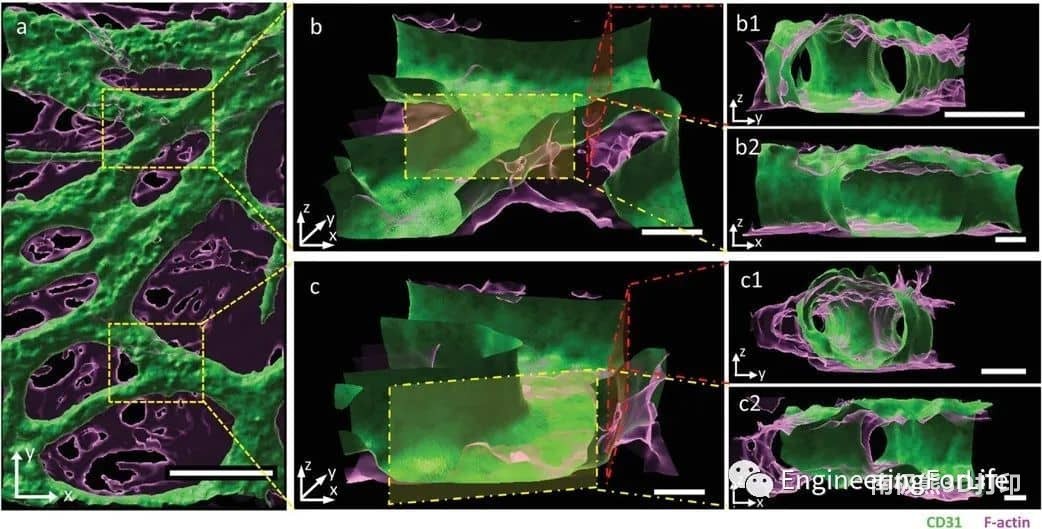
图6 不同角度的互联血管网络共聚焦图像
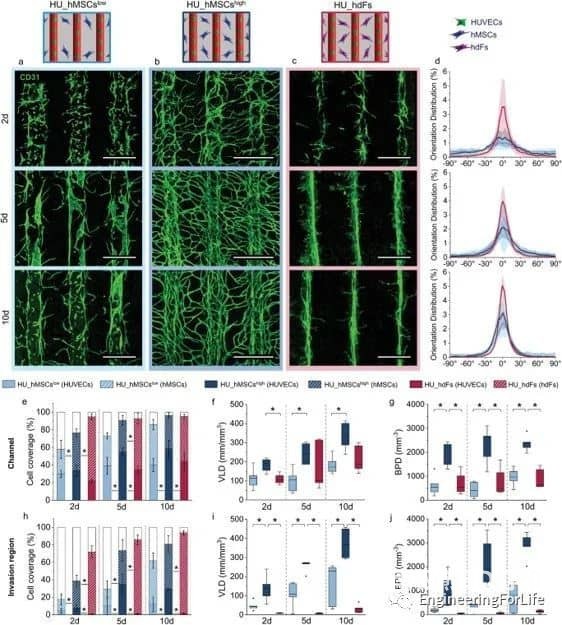
图7 通过改变细胞的位置、hMSCs的浓度和细胞类型来调节微血管结构的形成
该系统允许通过内皮衬里生成大血管通道,以及通过调节生物打印设置(即通过改变细胞位置、实体和剂量),通过细胞自组装过程形成可控的微血管结构。通过改变支持细胞的类型和位置,可以诱导和调节血管结构的形成。掺入细胞在培养数天内即可形成有管腔的微血管结构,并表现出稳定和成熟的迹象,并通过血管生成和吻合形成相互连接的血管网络。综上所述,研究人员通过设计不同的细胞空间排列来控制形成的血管结构的数量、方向、长度和分支行为,从而控制细胞间的相互作用、迁移和增殖,从而研究细胞类型和空间配置如何影响宏观和微观血管结构的自组装。这种将细胞自组装的能力与血管形成的空间控制相结合的创新策略允许发展独特而精确的血管化。考虑到组织工程和再生疗法的潜在用途,通过自组织形成的血管结构应优于人工生成的血管结构。这项工作代表了通过改变细胞类型和位置,通过细胞自组装来形成和调节微血管结构的系统研究。
文章来源:
https://doi.org/10.1002/adfm.202208325
(责任编辑:admin)
最新内容
热点内容


 Xenia进军大幅面增材制造
Xenia进军大幅面增材制造 研究人员基于3D打印冰模板
研究人员基于3D打印冰模板 美国Brooks与惠普合作开发
美国Brooks与惠普合作开发 《AHM》:3D打印为患者定
《AHM》:3D打印为患者定 MB Therapeutics与Lynxter
MB Therapeutics与Lynxter 美国国防部正在使用3D打印
美国国防部正在使用3D打印 美国空军引进3D砂
美国空军引进3D砂 3D打印个性化晶格
3D打印个性化晶格 伊犁州奎屯医院实
伊犁州奎屯医院实 昆士兰科技大学3D
昆士兰科技大学3D 全彩3D打印吉他在
全彩3D打印吉他在 PSAS成功发射3D打
PSAS成功发射3D打

